
Wetenschap
Waarom zijn elektronen in de buitenste schaal belangrijk?
* chemische binding: Valentie -elektronen zijn degenen die betrokken zijn bij het vormen van chemische bindingen. Ze kunnen worden gedeeld (covalente binding) of overgedragen (ionische binding) met andere atomen om een stabiele elektronenconfiguratie te bereiken.
* Reactiviteit: Het aantal valentie -elektronen bepaalt de reactiviteit van een element. Atomen met weinig valentie -elektronen zijn meestal zeer reactief omdat ze gemakkelijk elektronen aanschaffen of delen om een stabiele configuratie te bereiken. Omgekeerd zijn atomen met een volledige buitenste schaal over het algemeen niet -reactief (edelgassen).
* Fysieke eigenschappen: Valentie -elektronen beïnvloeden de fysische eigenschappen van een stof zoals smeltpunt, kookpunt en geleidbaarheid.
* chemische eigenschappen: Valentie -elektronen bepalen het vermogen van een element om verschillende soorten verbindingen en het algemene gedrag ervan in chemische reacties te vormen.
in eenvoudiger termen:
Stel je de buitenste schaal voor als de "sociale cirkel" van een atoom. De elektronen in deze cirkel zijn degenen die interageren met de 'sociale kringen' van andere atomen. Hoeveel vrienden hebben ze en hoe ze met anderen omgaan, bepalen de persoonlijkheid en het gedrag van het atoom.
Hier zijn enkele voorbeelden:
* natrium (na) Heeft één valentie -elektron, waardoor het zeer reactief is omdat het dit elektron gemakkelijk verliest om een positief ion te vormen.
* chloor (Cl) heeft zeven valentie -elektronen, waardoor het reactief is omdat het gemakkelijk één elektron krijgt om een negatief ion te vormen.
* helium (hij) Heeft een volledige buitenste schaal met twee valentie -elektronen, waardoor het uiterst niet -reactief wordt.
Het begrijpen van valentie -elektronen is cruciaal voor het begrijpen van de fundamentele principes van chemie, zoals hoe elementen verbinden, verbindingen vormen en met elkaar reageren.
 Hoe onderzoekers water uit de lucht oogsten
Hoe onderzoekers water uit de lucht oogsten  Visserijgeschiedenis wijst op substantiële achteruitgang voor belangrijke soorten
Visserijgeschiedenis wijst op substantiële achteruitgang voor belangrijke soorten Manieren om onze niet-hernieuwbare en hernieuwbare bronnen te beheren
Manieren om onze niet-hernieuwbare en hernieuwbare bronnen te beheren  Analyse van het geretourneerde kernmonster van Stonehenge helpt de duurzaamheid van megalieten te verklaren
Analyse van het geretourneerde kernmonster van Stonehenge helpt de duurzaamheid van megalieten te verklaren Ozonafbrekende stoffen veroorzaakten de helft van de opwarming van het noordpoolgebied in de late 20e eeuw. zegt studie
Ozonafbrekende stoffen veroorzaakten de helft van de opwarming van het noordpoolgebied in de late 20e eeuw. zegt studie
Hoofdlijnen
- Hoe de snelste spier ter wereld vier unieke vogelsoorten creëerde
- Stijgende temperaturen veranderen grote populatie zeeschildpadden vrouw
- Welke plantachtige kenmerken hebben euglenoïden?
- Hoe ontgift een enzym de cellen van levende wezens?
- Onderzoek onthult waarom spreeuwvrouwtjes vals spelen
- Waarom is het voordelig voor organismen zoals schimmels en algen om mutualistische relatie te vormen?
- Hoe voldoet de DNA -structuur aan de vereisten van een erfelijk molecuul?
- Je bent wat je eet is net zo belangrijk voor vissen als voor mensen
- Waarom mensen muzikaal zijn
- Onderzoeksgroep vindt manier om plastic afvalproducten om te zetten in vliegtuigbrandstof

- Wetenschappers gebruiken koolstofnanobuistechnologie om robuuste ontziltingsmembranen voor water te ontwikkelen
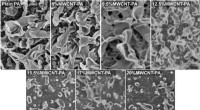
- De nieuw ontdekte architectuur van een koper-nitrenoïde-complex kan een revolutie teweegbrengen in de chemische synthese

- Transparant hout:het bouwmateriaal van de toekomst?

- Supercomputersimulaties onthullen de details van coronavirusfusie
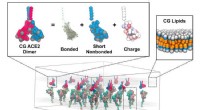
 Wat is de grootste uiterwaarden?
Wat is de grootste uiterwaarden?  Onderzoekers creëren een draadloze, batterijvrij, biologisch afbreekbare bloedstroomsensor
Onderzoekers creëren een draadloze, batterijvrij, biologisch afbreekbare bloedstroomsensor Pissebedden hebben het nieuwe record voor de kleinste verspreiders van ingenomen zaden
Pissebedden hebben het nieuwe record voor de kleinste verspreiders van ingenomen zaden  De vierkante meters in een driehoek berekenen
De vierkante meters in een driehoek berekenen  Zijn er 100 jaar lang stormen op Mercurius?
Zijn er 100 jaar lang stormen op Mercurius?  Waarom is de houding van open -mindedheid belangrijk?
Waarom is de houding van open -mindedheid belangrijk?  Gefrustreerde magnetische skyrmionen en antiskyrmionen kunnen nieuwe spintronische toepassingen mogelijk maken
Gefrustreerde magnetische skyrmionen en antiskyrmionen kunnen nieuwe spintronische toepassingen mogelijk maken Waarom geeft groen licht een lage mate van fotosynthese?
Waarom geeft groen licht een lage mate van fotosynthese?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

