
Wetenschap
Waarom is het mogelijk om equlibriumconstante te berekenen met behulp van hoeveelheden in plaats van concentraties?
Dit is waarom:
* evenwichtsconstante wordt gedefinieerd in termen van concentraties: De evenwichtsconstante (k) wordt gedefinieerd als de verhouding van producten en reactanten in evenwicht, elk verhoogd tot het vermogen van hun stoichiometrische coëfficiënt in de gebalanceerde chemische vergelijking . Deze verhouding wordt uitgedrukt in termen van concentraties (mol/l) , niet alleen bedragen.
* BEDRIJVEN ALLEEN weerspiegelen niet het volume: De hoeveelheid van een stof (in mol) vertelt u niet hoeveel ervan aanwezig is per volume -eenheid. 1 mol van een stof opgelost in 1 L water heeft bijvoorbeeld een andere concentratie dan 1 mol van dezelfde stof opgelost in 2 L water.
* evenwichtsconstante is een eigenschap van de reactie: De evenwichtsconstante is een specifieke waarde voor een gegeven reactie bij een gegeven temperatuur. Het weerspiegelt de relatieve hoeveelheden producten en reactanten die aanwezig zijn in evenwicht, die afhankelijk zijn van hun concentraties, niet alleen op hun hoeveelheden.
Om de evenwichtsconstante (k) te berekenen, moet u weten:
1. De gebalanceerde chemische vergelijking voor de reactie.
2. De evenwichtsconcentraties van alle reactanten en producten.
Voorbeeld:
Overweeg de reactie:
`` `
A + B <=> C + D
`` `
De evenwichtsconstante (k) is:
`` `
K =[c] [d] / [a] [b]
`` `
Waarbij [a], [b], [c] en [d] de evenwichtsconcentraties van elke soort in mol/l vertegenwoordigen.
Samenvattend:
* U kunt de evenwichtsconstante niet alleen berekenen met behulp van hoeveelheden alleen.
* U moet concentraties (mol/l) gebruiken om K.
* K is een specifieke waarde voor een gegeven reactie bij een gegeven temperatuur en weerspiegelt de relatieve hoeveelheden producten en reactanten in evenwicht.
 Antarctische stormen doorstaan:weerballongegevens verbeteren de voorspellingsvaardigheid
Antarctische stormen doorstaan:weerballongegevens verbeteren de voorspellingsvaardigheid De stranden van Californië zijn aan het eroderen:een expert legt uit hoe je ze kunt redden
De stranden van Californië zijn aan het eroderen:een expert legt uit hoe je ze kunt redden  Zeeturbulentie vastleggen aan de onderkant van zee-ijs
Zeeturbulentie vastleggen aan de onderkant van zee-ijs Wanneer weten we dat we buitenaards leven hebben gevonden?
Wanneer weten we dat we buitenaards leven hebben gevonden?  Waar komt water vandaan?
Waar komt water vandaan?
Hoofdlijnen
- Onderzoekers vinden eerste wilde alligator brekende schildpad in Illinois sinds 1984
- Waarom heeft de moderne mens de Neanderthalers vervangen? De sleutel zou in onze sociale structuren kunnen liggen
- Uit onderzoek blijkt hoe vrouwtjes het 'juiste' sperma kiezen
- Welk proces wordt gebruikt om grotere en betere nakomelingen te creëren?
- Welke organismen verdelen door splitsing voor splitsing?
- Welk land kloneert het meest?
- Welke soorten bewijs worden gebruikt voor het classificeren van organismen in het Linnaean -classificatiesysteem?
- Prolifereren of niet prolifereren? Een cellulaire lente antwoordt
- Wat is de rol van DMSO in de celkweek?
- Een theoretische studie verklaart de natuurlijke selectie van eiwitten
- Afluisteren van afzonderlijke moleculen met licht door het gebabbel opnieuw af te spelen

- Wetenschappers kijken voor het eerst naar het geometrische fase-effect in een chemische reactie

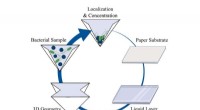
- Gevouwen papier creëert een draagbaar laboratorium voor veldlaboratoriumtests
- Onderzoekers bieden inzicht in lichtgewicht materiaal dat uitzet bij warmte

 Een parallelschakeling maken om lampen aan te schakelen
Een parallelschakeling maken om lampen aan te schakelen Welk organel wordt voornamelijk erkend met het gesprek van potentiële energie -organische verbindingen in geschikte vorm voor onmiddellijk gebruik door cel?
Welk organel wordt voornamelijk erkend met het gesprek van potentiële energie -organische verbindingen in geschikte vorm voor onmiddellijk gebruik door cel?  Als het met mineralen te maken heeft, welk woord betekent dat dan?
Als het met mineralen te maken heeft, welk woord betekent dat dan?  Geëvolueerde adapter voor toekomstige vluchten van het NASA-ruimtelanceersysteem, gereed voor testen
Geëvolueerde adapter voor toekomstige vluchten van het NASA-ruimtelanceersysteem, gereed voor testen  Wat zijn drie voorbeelden van wetenschap in je dagelijkse leven?
Wat zijn drie voorbeelden van wetenschap in je dagelijkse leven?  Waarom het vliegen met een helikopter op Mars zo belangrijk is
Waarom het vliegen met een helikopter op Mars zo belangrijk is  Armoede beïnvloedt contact met kinderbescherming
Armoede beïnvloedt contact met kinderbescherming Rennen naar de wortels:bodemvocht beïnvloedt de snelheid van nematoden
Rennen naar de wortels:bodemvocht beïnvloedt de snelheid van nematoden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

