
Wetenschap
Wat voor soort molecuul kan waterstofbinding ervaren?
1. Een waterstofatoom bond direct aan een sterk elektronegatief atoom. Dit zeer elektronegatieve atoom is meestal zuurstof (O), stikstof (N) of fluor (F) .
2. Een eenzaam paar elektronen op een ander elektronegatief atoom (O, N, of F) in een nabijgelegen molecuul.
In wezen vindt waterstofbinding plaats wanneer een waterstofatoom wordt aangetrokken tot een eenzaam paar elektronen op een aangrenzend elektronegatief atoom. Dit resulteert in een sterke dipool-dipool-interactie tussen de moleculen.
Hier zijn enkele voorbeelden van moleculen die waterstofbinding kunnen ervaren:
* Water (H2O): De waterstofatomen zijn gebonden aan zuurstof, wat zeer elektronegatief is.
* ammoniak (NH3): De waterstofatomen zijn gebonden aan stikstof, wat ook zeer elektronegatief is.
* ethanol (CH3CH2OH): Het waterstofatoom bevestigd aan het zuurstofatoom kan deelnemen aan waterstofbinding.
* waterstoffluoride (HF): Het waterstofatoom is gebonden aan fluor, het meest elektronegatieve element.
Opmerking: Waterstofbinding is een relatief sterk type intermoleculaire kracht, dat de hoge kookpunten van water en andere moleculen verklaart die waterstofbruggen kunnen vormen.
 Wat zullen we waarnemen als verdund zoutzuur wordt toegevoegd aan een kleine hoeveelheid koperoxide in een bekerglas?
Wat zullen we waarnemen als verdund zoutzuur wordt toegevoegd aan een kleine hoeveelheid koperoxide in een bekerglas?  COP24:Hoe een plasticverdrag onze oceanen zou kunnen opruimen
COP24:Hoe een plasticverdrag onze oceanen zou kunnen opruimen  Waar bevinden zich de chemoreceptoren voor de detectie van een laag zuurstofgehalte in het lichaam?
Waar bevinden zich de chemoreceptoren voor de detectie van een laag zuurstofgehalte in het lichaam?  Wat zijn de gebruikelijke toepassingen van titanium?
Wat zijn de gebruikelijke toepassingen van titanium?  Wat is de vloeistof die jodiumvlekken verwijdert?
Wat is de vloeistof die jodiumvlekken verwijdert?
 Waarom de veranderende kleur van straatverlichting een gevaar kan zijn voor insectenpopulaties
Waarom de veranderende kleur van straatverlichting een gevaar kan zijn voor insectenpopulaties  Uitdaging en verlangen in Antarctische meteorologie en klimaat
Uitdaging en verlangen in Antarctische meteorologie en klimaat Modelbiascorrecties voor betrouwbare projectie van extreme El Niño-frequentieverandering
Modelbiascorrecties voor betrouwbare projectie van extreme El Niño-frequentieverandering Hoe het vreemdste zoogdier op aarde zo bizar werd
Hoe het vreemdste zoogdier op aarde zo bizar werd  Hoe Finland omarmde om ‘de gelukkigste natie ter wereld’ te zijn
Hoe Finland omarmde om ‘de gelukkigste natie ter wereld’ te zijn
Hoofdlijnen
- Atomair zicht op cellulaire pomp laat zien hoe bacteriën eiwitten uitzenden
- Vergelijk en contrasteer het zenuwstelsel met endocrien systeem?
- Vetmolecuul in menselijk bloed controleert malariaparasieten beslissing om op muggen te springen
- Welke organismen bevatten cellulose?
- Welke omstandigheden kunnen de groei van bacteriën hebben bevorderd?
- Hoe werken het bloedsomloop- en spijsverteringssysteem samen om voedsel te leveren, alle cellenlichaam?
- Een bepaald type diploïde cel bevat 58 chromosomen Hoeveel zou u verwachten dat een gamete van dit organisme zal bevatten?
- Wat bestaat een organisme dat bestaat uit 1 cel genaamd?
- Wat de afnemende kariboe-populaties en het totale jachtverbod betekenen voor de Inuit-gemeenschappen in Labrador
- Aangeraakt door licht:Foto-geëxciteerde stannylanionen zijn geweldig voor het produceren van organotinverbindingen

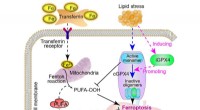
- Gericht op een nieuwe induceerbare isovorm voor de behandeling van metabole gerelateerde leververvetting
- Zacht maar sterk:biohybride materiaal presteert als kraakbeen
- Nieuwe genetische methode verbetert de efficiëntie van het enzym

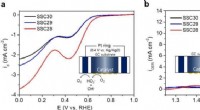
- Onderzoekers ontwikkelen hoogwaardige perovskietoxide-katalysatoren met behulp van laat-overgangsmetaaloxidematerialen
 Een equivalentiepunt vinden Titratie
Een equivalentiepunt vinden Titratie  Brandweerlieden blootgesteld aan meer potentieel schadelijke chemicaliën dan eerder werd gedacht
Brandweerlieden blootgesteld aan meer potentieel schadelijke chemicaliën dan eerder werd gedacht Kunnen internetstralende ballonnen de veranderende wind te slim af zijn?
Kunnen internetstralende ballonnen de veranderende wind te slim af zijn?  Onderzoekers onthullen hoe planten zichzelf beschermen tegen virale infecties door deacetylering te reguleren
Onderzoekers onthullen hoe planten zichzelf beschermen tegen virale infecties door deacetylering te reguleren  Hoe maak je lithiumhydride?
Hoe maak je lithiumhydride?  Waarom moet je fossiele brandstoffen gebruiken?
Waarom moet je fossiele brandstoffen gebruiken?  Wetenschappers observeren de rol van cavitatie bij het breken van glas
Wetenschappers observeren de rol van cavitatie bij het breken van glas Nieuwe bio-geïnspireerde methode om hoogwaardig grafeen te kweken voor hoogwaardige elektronische apparaten
Nieuwe bio-geïnspireerde methode om hoogwaardig grafeen te kweken voor hoogwaardige elektronische apparaten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

