
Wetenschap
Hoe hio4 ioniseert in IO3 -ion?
Stap 1:Vorming van IO3-
HIO4 (periodiek zuur) is een sterk zuur. In waterige oplossingen verliest het gemakkelijk één proton om het waterstof periodaation (HIO4-) te vormen :
HIO4 + H2O → HIO4- + H3O +
Stap 2:Verdere ionisatie (als de omstandigheden gunstig zijn)
Het waterstof periodaation (HIO4-) kan een proton verder verliezen in een tweede ionisatiestap, hoewel dit minder waarschijnlijk zal optreden:
HIO4- + H2O → IO42- + H3O +
Sleutelpunten:
* HiO4 is een sterk zuur: Dit betekent dat het gemakkelijk protonen doneert om H3O+ (hydroniumionen) te vormen, waardoor de oplossing zuur wordt.
* IO3- Vorming is geen directe ionisatie: HiO4 produceert niet direct IO3-ionen. Het verliest eerst een proton om HIO4- te worden en vervolgens mogelijk een tweede proton om IO42- te worden.
Opmerking: Het werkelijke evenwicht en speciatie van periodiekzuur in oplossing kan complex zijn en afhankelijk zijn van verschillende factoren zoals pH, temperatuur en concentratie. De bovenstaande stappen bieden echter een vereenvoudigd begrip van het ionisatieproces.
 Een nieuwe katalysator om de opwarming van de aarde te vertragen
Een nieuwe katalysator om de opwarming van de aarde te vertragen Nieuwe biosyntheseroute die uniek is voor pathogene micro-organismen
Nieuwe biosyntheseroute die uniek is voor pathogene micro-organismen Is Chyme een langzame bewegende of snelle vloeistof?
Is Chyme een langzame bewegende of snelle vloeistof?  De richting in whick een omkeerbare reactie zal doorgaan kan worden voorspeld uit de wetten van?
De richting in whick een omkeerbare reactie zal doorgaan kan worden voorspeld uit de wetten van?  Hoeveel mol zitten er in 2,9 x 1021 formule-eenheden NaCl?
Hoeveel mol zitten er in 2,9 x 1021 formule-eenheden NaCl?
 Duizenden scholen sluiten terwijl smog India omhult, Pakistan
Duizenden scholen sluiten terwijl smog India omhult, Pakistan Wat is het verschil tussen een meer en een vijver?
Wat is het verschil tussen een meer en een vijver?  Het eerste gebruik van weersvoorspellingen om de menselijke impact op extremen aan te tonen is 'transformationeel', zeggen wetenschappers
Het eerste gebruik van weersvoorspellingen om de menselijke impact op extremen aan te tonen is 'transformationeel', zeggen wetenschappers  De tijd dringt in de tropen - onderzoekers waarschuwen voor een wereldwijde ineenstorting van de biodiversiteit
De tijd dringt in de tropen - onderzoekers waarschuwen voor een wereldwijde ineenstorting van de biodiversiteit Onderzoek:reis van PFAS in afvalwaterinstallaties belicht uitdagingen op het gebied van regelgeving
Onderzoek:reis van PFAS in afvalwaterinstallaties belicht uitdagingen op het gebied van regelgeving
Hoofdlijnen
- De aanwijzing zit in de lijm:onderzoek laat zien hoe planten het bij elkaar houden tijdens de groei
- Welk organel is verantwoordelijk voor de afvalverwerking en recycling in een dierlijke cel?
- Waarom zijn er 61 Anticodonen?
- Mycoheterotrofe planten als sleutel tot het Wood Wide Web
- Wat is een chemisch signaalmolecuul dat werkt om specifieke fysiologische processen te regelen of te reguleren?
- Wetenschappers leggen uit hoe chromosomen zich reorganiseren na celdeling
- Wat zijn voorbeelden van homozygote dominanten?
- Wat is de definitie van hersenstam en cerebellum?
- Hoe moleculaire spieren cellen helpen delen
- Microscopietechniek onthult cellen 3-D ultrastructuur in nieuw detail
- Antidegranulatie en galzuurbindende activiteit van fruit en agro-industriële bijproducten

- Nieuwe supercondensors slaan elektrische lading op in textielmaterialen

- Parallel gekoppelde celgecentreerde eindig volume thermische rooster Boltzmann-methode op ongestructureerde roosters
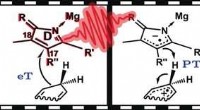
- Stapsgewijze hydrideoverdracht in de biosynthese van chlorofyl
 Materiaalwetenschappers leren hoe ze vloeibare kristallen van vorm kunnen veranderen
Materiaalwetenschappers leren hoe ze vloeibare kristallen van vorm kunnen veranderen Wat is de functie van eenvoudig kolomvormig epitheel?
Wat is de functie van eenvoudig kolomvormig epitheel?  Welk van de volgende woorden kan niet als bijwoord worden gebruikt?
Welk van de volgende woorden kan niet als bijwoord worden gebruikt?  Daycare Cleaning Checklist
Daycare Cleaning Checklist  Hoe som of het verschil van wiskundige problemen te vinden
Hoe som of het verschil van wiskundige problemen te vinden nieuwe veiliger, goedkope manier om kleine satellieten voort te stuwen
nieuwe veiliger, goedkope manier om kleine satellieten voort te stuwen Fusie Hoe kernreactoren werken
Fusie Hoe kernreactoren werken  Nieuwe AI-techniek kan leiden tot innovaties in biomaterialen
Nieuwe AI-techniek kan leiden tot innovaties in biomaterialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

