
Wetenschap
Wat is de elektronische geometrie van H2CO3?
H2CO3, koolzuur, heeft een trigonale vlakke vlakke Elektronische geometrie rond het centrale koolstofatoom.
Dit is waarom:
* centraal atoom: Het centrale atoom in koolzuur is koolstof.
* valentie -elektronen: Koolstof heeft 4 valentie -elektronen.
* binding: Koolstof vormt 4 bindingen:2 dubbele bindingen met zuurstofatomen en 2 enkele bindingen met hydroxylgroepen (OH).
* eenzame paren: Het koolstofatoom heeft geen eenzame paar elektronen.
Daarom is de elektronische geometrie rond het koolstofatoom trigonaal vlakke vlakke.
Opmerking: De moleculaire geometrie van koolzuur is anders. Vanwege de aanwezigheid van de twee hydroxylgroepen is de moleculaire geometrie rond de centrale koolstof gebogen (of V-vormig).
 Voorbeelden van radio-isotoop en hun halfwaardetijd?
Voorbeelden van radio-isotoop en hun halfwaardetijd?  Onderzoekers vinden nieuwe suikervervangers in citrus die de voedings- en drankenindustrie kunnen veranderen
Onderzoekers vinden nieuwe suikervervangers in citrus die de voedings- en drankenindustrie kunnen veranderen Wat is de uitgebalanceerde chemische vergelijking voor bariumbromide en lood-2-nitraat?
Wat is de uitgebalanceerde chemische vergelijking voor bariumbromide en lood-2-nitraat?  Moleculaire additieven verbeteren de mechanische eigenschappen van organisch zonnecelmateriaal
Moleculaire additieven verbeteren de mechanische eigenschappen van organisch zonnecelmateriaal Om een hardheid van een mineraal te vinden waar zou je naar kijken?
Om een hardheid van een mineraal te vinden waar zou je naar kijken?
Hoofdlijnen
- Welk element van het wetenschappelijke proces kan niet worden gewijzigd?
- Waar komen de verschillende fasen van fotosynthese voor in cel?
- Wat is het resultaat dat DNA verschillende secties van zijn informatie in- en uitschakelt?
- Voor het eerst vogelgriep gedetecteerd bij alpaca's in de VS
- Structurele niveaus van organisatie van het menselijk lichaam
- Welk genotype zou resulteren in bloedgroep A?
- Zijn het echte wetenschappers niet moeten experimenten herhalen om te zien of thir -gegevens reproduceerbaar zijn?
- Welke organismen leefden tijdens het Cenozoïcum?
- Houdt mijn hond echt van mij?
- Maggot-analyse wordt moleculair voor forensische zaken

- Hoe elektrische velden een moleculaire draaiing in lichtgevoelige eiwitten beïnvloeden
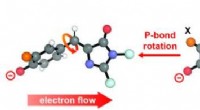
- Wetenschappers zetten giftige pesticiden om in behandeling tegen antibioticaresistente bacteriën
- Spinzijde sleutel tot nieuwe botfixerende composiet

- Licht in het donker schijnen:nieuwe ontdekking maakt microscopische beeldvorming mogelijk in donkere omstandigheden

 Wat houdt zwarte ondernemers tegen?
Wat houdt zwarte ondernemers tegen?  Hoe bestuur je een fiets?
Hoe bestuur je een fiets?  Feiten over babygiraffen
Feiten over babygiraffen Bleners in stedelijke gebieden hebben het meeste moeite om aan hun hypotheek te voldoen, blijkt uit studieprogramma's
Bleners in stedelijke gebieden hebben het meeste moeite om aan hun hypotheek te voldoen, blijkt uit studieprogramma's Bevat een exotherme reactie meer chemische energie dan reactanten?
Bevat een exotherme reactie meer chemische energie dan reactanten?  Jupiter:anatomie van een gasreus
Jupiter:anatomie van een gasreus  Wie ontdekte hoe je in 1831 elektriciteit kunt maken?
Wie ontdekte hoe je in 1831 elektriciteit kunt maken?  Nieuwe manier om dichte dubbele zwarte gaten te vormen
Nieuwe manier om dichte dubbele zwarte gaten te vormen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

