
Wetenschap
Waarom bindt 1 natriumatoom zich aan het chlooratoom?
Natrium heeft één valentie-elektron, dat het gemakkelijk opgeeft om een stabiele elektronenconfiguratie te bereiken, zoals edelgassen. Chloor heeft zeven valentie-elektronen en heeft nog één elektron nodig om zijn stabiele octet te voltooien.
Wanneer natrium in contact komt met chloor, draagt het natriumatoom zijn enkele valentie-elektron over aan het chlooratoom, wat resulteert in de vorming van positief geladen natriumion (Na+) en een negatief geladen chloride-ion (Cl-). De elektrostatische aantrekkingskracht tussen deze tegengesteld geladen ionen houdt de verbinding bij elkaar en vormt natriumchloride (NaCl), een stabiele ionische verbinding.
Deze verhouding van 1:1 van natrium- en chlooratomen is nodig om de elektrische neutraliteit te behouden. Elk natriumatoom verliest één elektron en elk chlooratoom krijgt één elektron, dus de algehele lading van de verbinding blijft neutraal.
 Voorkomen van lithiumverlies voor lithium-ionbatterijen met hoge capaciteit
Voorkomen van lithiumverlies voor lithium-ionbatterijen met hoge capaciteit Is calciumbromide zuur of base?
Is calciumbromide zuur of base?  Nieuwe katalysator zet koolstofdioxide efficiënt om in bruikbare brandstoffen en chemicaliën
Nieuwe katalysator zet koolstofdioxide efficiënt om in bruikbare brandstoffen en chemicaliën Simulaties verklaren detonatie-eigenschappen in TATB
Simulaties verklaren detonatie-eigenschappen in TATB Hoe de petro uit de petrochemische industrie te halen?
Hoe de petro uit de petrochemische industrie te halen?
Hoofdlijnen
- Wetenschappers ontcijferen hoe planten zonnebrand voorkomen
- Hoe wordt een darmmicrobe een ziekteverwekker?
- De kenmerken van de mitochondria
- Onderzoekers laten zien hoe alternatieven voor vismeel en olie de groei van de aquacultuur kunnen ondersteunen
- Zelfs als je nog niet weet dat je ziek bent, je gezicht zal je verraden
- Hoe een dirigent chaos in vroege muizenembryo’s begrijpt
- Nieuwe methodologie voorspelt coronavirus en andere infectieziektebedreigingen voor dieren in het wild
- 3 fasen van interfase
- Hoe vaccins werken
- Nieuw composietmateriaal heeft potentieel voor medisch gebruik

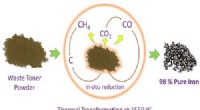
- Strijkijzer uit printerafvaltoner trekken
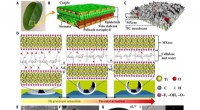
- Bio-geïnspireerde op MXene gebaseerde actuatoren voor programmeerbare slimme apparaten
- Onderzoekers simuleren dynamische auto-emissies met behulp van gouden nanodeeltjes voor katalyse

- Versleten banden kunnen worden hergebruikt in nieuwe asfaltwegen

 Thermische energiewetenschapsexperimenten voor kinderen
Thermische energiewetenschapsexperimenten voor kinderen Landbouw in Europa neemt af naarmate Aziatische productie groeit:VN, OESO
Landbouw in Europa neemt af naarmate Aziatische productie groeit:VN, OESO Luistert je telefoon echt naar je gesprekken? Nou, het blijkt dat het niet hoeft
Luistert je telefoon echt naar je gesprekken? Nou, het blijkt dat het niet hoeft Een NASA-ruimtevaartuig is op koers om materiaal van een asteroïde aarde af te leveren. Dit is wat we zouden kunnen leren
Een NASA-ruimtevaartuig is op koers om materiaal van een asteroïde aarde af te leveren. Dit is wat we zouden kunnen leren  Bereken de gemiddelde omzet
Bereken de gemiddelde omzet  Zimbabwe verklaart de El Nino-droogte tot een nationale ramp
Zimbabwe verklaart de El Nino-droogte tot een nationale ramp  Het pad voor cellen verlichten
Het pad voor cellen verlichten Onderzoeksteam zet het vuur op 3D-printinkten
Onderzoeksteam zet het vuur op 3D-printinkten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

