
Wetenschap
Bij constante druk neemt een vaste gasmassa een volume in van 20 m3 bij 27 ° C. Het temperatuursysteem werd verhoogd naar 177. Bereken is er nieuw gas ingenomen?
V₁/T₁ =V₂/T₂
waarbij V₁ en T₁ respectievelijk het initiële volume en de temperatuur vertegenwoordigen, en V2 en T₂ respectievelijk het uiteindelijke volume en de temperatuur vertegenwoordigen.
In dit geval weten we dat het beginvolume (V₁) 20 m³ is, de begintemperatuur (T₁) 27 °C en de eindtemperatuur (T₂) 177 °C. We moeten het uiteindelijke volume (V₂) vinden.
Eerst moeten we de temperaturen omzetten naar Kelvin. We voegen 273 toe aan elke temperatuur:
T₁ =27 °C + 273 =300 K
T₂ =177 °C + 273 =450 K
Nu kunnen we de waarden vervangen door de vergelijking van de wet van Charles:
V₁/T₁ =V₂/T₂
20 m³ / 300 K =V₂ / 450 K
Als we V₂ oplossen, krijgen we:
V₂ =(20 m³ * 450 K) / 300 K
V₂ =30 m³
Het nieuwe volume dat door het gas wordt ingenomen bedraagt dus 30 m³.
 Superharde materiaalsynthese goedkoper gemaakt
Superharde materiaalsynthese goedkoper gemaakt Vacaturedynamiek op met CO bedekte Pt(111)-elektroden
Vacaturedynamiek op met CO bedekte Pt(111)-elektroden Wat is het grensgetal voor het verschil in elektronegatief om te bepalen of een binding ionisch of covalent is?
Wat is het grensgetal voor het verschil in elektronegatief om te bepalen of een binding ionisch of covalent is?  Wetenschappers ontwikkelen mangaanoxidekatalysator met instelbare zuurgraad en selectiviteit
Wetenschappers ontwikkelen mangaanoxidekatalysator met instelbare zuurgraad en selectiviteit Knijp er gewoon in - onderzoekers ontdekken wanneer ruimtes krap zijn, de natuur versoepelt haar wetten
Knijp er gewoon in - onderzoekers ontdekken wanneer ruimtes krap zijn, de natuur versoepelt haar wetten
 Verbod op hoteltoiletartikelen is de nieuwste poging om plastic afval in te dammen
Verbod op hoteltoiletartikelen is de nieuwste poging om plastic afval in te dammen Na een kernoorlog, 's werelds noodvoedselvoorziening zou zeevruchten kunnen zijn - als overbevissing nu stopt
Na een kernoorlog, 's werelds noodvoedselvoorziening zou zeevruchten kunnen zijn - als overbevissing nu stopt Nationaal onderwijsbeleid -- oh, wat is het veranderd
Nationaal onderwijsbeleid -- oh, wat is het veranderd  Ijsafzettingen op de Arctische rivieren verdwijnen snel
Ijsafzettingen op de Arctische rivieren verdwijnen snel Hoe leggen slangen eieren?
Hoe leggen slangen eieren?
Hoofdlijnen
- Biologie is wat, als milieu, wat?
- Onderzoekers tonen aan dat nucleosomen de efficiëntie van CRISPR-Cas9-splitsing kunnen remmen
- Hoe een cel te splitsen in Two
- Wat is microtoxine?
- Is die schildpad legaal? Bestrijding van de handel in wilde dieren en planten met stabiele isotopen
- Nieuwe slimme sensor om boeren te helpen kreupelheid bij schapen te herkennen
- Wat is de definitie van hersenstam en cerebellum?
- Farmacie Onderzoek Onderwerpen
- Onthoud mij? Geslacht en ras kunnen ervoor zorgen dat u vergeetbaar wordt
- Hoe inktviscamouflage huidkanker bij mensen kan helpen voorkomen

- Spannende nieuwe ontwikkelingen voor polymeren gemaakt van afvalzwavel

- Organische kleurstof in de tussenlaag van zinkoxide stabiliseert en verbetert de prestaties van organische zonnecellen
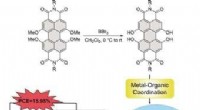
- Nieuw inzicht in de oppervlakte-eigenschappen van tweedimensionale MXenes-materialen

- Onderzoek wijst op tweede kans voor afgewezen antibioticumkandidaat

 Wat zijn de producten van de ontledingsreactie?
Wat zijn de producten van de ontledingsreactie?  Klimaatvriendelijke metaalproductie:waarom is het moeilijk?
Klimaatvriendelijke metaalproductie:waarom is het moeilijk? Hoe consumenten in de supermarkt anders uitgeven in tijden van economische verandering
Hoe consumenten in de supermarkt anders uitgeven in tijden van economische verandering Student Hyperloop-motor getest bij ESA
Student Hyperloop-motor getest bij ESA Biohybride microrobots kunnen micro- en nanoplastics uit aquatische omgevingen verwijderen
Biohybride microrobots kunnen micro- en nanoplastics uit aquatische omgevingen verwijderen  Hoe een Math Compass
Hoe een Math Compass Satellieten brengen overstromingen in West-Europa in kaart
Satellieten brengen overstromingen in West-Europa in kaart De eerste helft van 2017 staat op de 2e plaats wereldwijd, achter 2016
De eerste helft van 2017 staat op de 2e plaats wereldwijd, achter 2016
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

