
Wetenschap
Waar dissocieert azijnzuur in?
De chemische vergelijking voor de dissociatie van azijnzuur kan als volgt worden weergegeven:
CH3COOH <=> H+ + CH3COO-
In deze evenwichtsreactie fungeert het azijnzuurmolecuul (CH3COOH) als het zwakke zuur, waarbij het een waterstofion (H+) doneert om in oplossing een hydroniumion (H3O+) te vormen. Het acetaation (CH3COO-) is de geconjugeerde base van azijnzuur.
De mate van dissociatie van azijnzuur in water is relatief laag, wat betekent dat slechts een klein deel van de zuurmoleculen daadwerkelijk in ionen dissocieert. Deze dissociatie is echter voldoende om azijnzuur zijn karakteristieke zure eigenschappen te geven, zoals een zure smaak en het vermogen om met basen te reageren en H+-ionen vrij te geven.
 Wat is het oxidatiegetal voor kobalt III-fosfaat?
Wat is het oxidatiegetal voor kobalt III-fosfaat?  Onderzoek effent de weg voor de volgende generatie kristallijne materiaalzeefapparatuur
Onderzoek effent de weg voor de volgende generatie kristallijne materiaalzeefapparatuur Welke methode van warmteoverdracht is bibingka koken?
Welke methode van warmteoverdracht is bibingka koken?  Chemici ontsluiten het potentieel van fluoralkenen
Chemici ontsluiten het potentieel van fluoralkenen Als het aantal mol gas afneemt, wat gebeurt er dan met het volume?
Als het aantal mol gas afneemt, wat gebeurt er dan met het volume?
 What Are Shrimps Prey?
What Are Shrimps Prey?  Ontbossing verduistert de zeeën boven het op een na grootste rif ter wereld
Ontbossing verduistert de zeeën boven het op een na grootste rif ter wereld Modelsimulatie-experimenten geven wetenschappers een beter begrip van factoren die moessongedrag beïnvloeden
Modelsimulatie-experimenten geven wetenschappers een beter begrip van factoren die moessongedrag beïnvloeden UNEP-chef vertrouwt erop dat VS klimaatdeal Parijs niet zal schrappen
UNEP-chef vertrouwt erop dat VS klimaatdeal Parijs niet zal schrappen Van de kust tot de diepzee beïnvloeden veranderende zuurstofniveaus het leven in zee op verschillende manieren
Van de kust tot de diepzee beïnvloeden veranderende zuurstofniveaus het leven in zee op verschillende manieren
Hoofdlijnen
- Biologen leggen uit hoe organismen mutaties kunnen tolereren en zich toch kunnen aanpassen aan veranderingen in het milieu
- Hoeveel verschillende evolutieovertuigingen zijn er?
- Hoe planten reageren op schimmels
- Wat is troebelheid en wat staat er in de microbiologie?
- Hoe werken Golgi-lichamen om celproducten op te slaan?
- Hoe beïnvloedt de temperatuur het metabolisme?
- Wat is de reden voor hemiparese?
- Dammen en andere barrières voor paaigebieden voor zalm zorgen voor uitdagingen voor visserijbeheerders
- Nieuwe database catalogiseert planten die verontreiniging opnemen
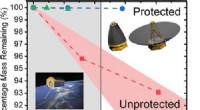
- Doorbraakmateriaal kan satellieten beschermen tegen ultraviolette straling en atomaire zuurstof in een lage baan om de aarde
- Uitdagingen bij de ontwikkeling van elektrokatalysatoren

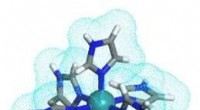
- Nieuw multi-protondragercomplex als efficiënte protongeleider bij hoge temperaturen
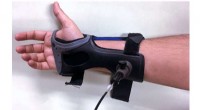
- Onderzoekers tonen effectiviteit nieuwe niet-invasieve bloedglucosetest aan
- Onderzoekers ontwikkelen de eerste functionele niet-eigen metaalhydrogenase

 Door de wetenschap gesteunde manieren om een nieuwe studie te beginnen Habit
Door de wetenschap gesteunde manieren om een nieuwe studie te beginnen Habit Kunnen taalmodellen het genoom lezen? Deze decodeerde mRNA om betere vaccins te maken
Kunnen taalmodellen het genoom lezen? Deze decodeerde mRNA om betere vaccins te maken  Hoe technologieën voor schoon water een boost kunnen krijgen van röntgensynchrotrons
Hoe technologieën voor schoon water een boost kunnen krijgen van röntgensynchrotrons Welke massa in gram vloeistof is 34,6 ml vloeistof?
Welke massa in gram vloeistof is 34,6 ml vloeistof?  Geologische kaart van de hele maan op schaal 1:2,500,000
Geologische kaart van de hele maan op schaal 1:2,500,000 Meer dan de helft van de kinderen in Engeland en Wales nu geboren uit ongehuwde ouders
Meer dan de helft van de kinderen in Engeland en Wales nu geboren uit ongehuwde ouders Beschermt de magnetosfeer van de aarde ons tegen de zon? Zonnewind?
Beschermt de magnetosfeer van de aarde ons tegen de zon? Zonnewind?  Duurzame dammen:zijn ze mogelijk? Deskundige weegt mee
Duurzame dammen:zijn ze mogelijk? Deskundige weegt mee
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

