
Wetenschap
Waarom is pentahydride van stikstof niet mogelijk?
Stikstof heeft vijf valentie-elektronen. Om aan de octetregel te voldoen, heeft het nog drie elektronen nodig. In ammoniak (NH3) vormt stikstof drie covalente bindingen met drie waterstofatomen, die elk één elektron bijdragen. Dit geeft stikstof in totaal acht elektronen, wat voldoet aan de octetregel.
Om pentahydride van stikstof (NH5) te vormen, zou stikstof vijf covalente bindingen met vijf waterstofatomen moeten vormen. Dit is echter niet mogelijk omdat stikstof slechts vijf valentie-elektronen heeft. Zelfs als stikstof vijf covalente bindingen zou kunnen vormen, zou het molecuul zeer onstabiel zijn vanwege het grote aantal elektronenparen rond het stikstofatoom.
Daarom is pentahydride van stikstof niet mogelijk.
 Hoe zal het klimaat zijn als het volgende supercontinent van de aarde wordt gevormd?
Hoe zal het klimaat zijn als het volgende supercontinent van de aarde wordt gevormd? Chemisch kantelpunt van magma bepaalt explosief potentieel van vulkanen
Chemisch kantelpunt van magma bepaalt explosief potentieel van vulkanen De grenzen van het ijs:wat een 19e-eeuwse expeditie die een jaar lang vastzat in zee-ijs ons vertelt over de toekomst van Antarctica
De grenzen van het ijs:wat een 19e-eeuwse expeditie die een jaar lang vastzat in zee-ijs ons vertelt over de toekomst van Antarctica  Studie onderzoekt extreme neerslaggebeurtenissen in verschillende regio's van het Tibetaanse plateau
Studie onderzoekt extreme neerslaggebeurtenissen in verschillende regio's van het Tibetaanse plateau  Wetenschappers meten de dikte van Kilauea-lavastromen op Hawaï
Wetenschappers meten de dikte van Kilauea-lavastromen op Hawaï
Hoofdlijnen
- Hoe klonen werkt
- Dolfijnen slaan mensen, chimpansees bij vroege tekenen van zelfbewustzijn
- Colombia - een megadivers paradijs dat nog ontdekt moet worden
- Biosynthetische geheimen:hoe schimmels bioactieve verbindingen maken
- Druk in de baarmoeder kan de gezichtsontwikkeling beïnvloeden
- Kunnen bacteriële lifters de vorming van nieuwe gastheersoorten beïnvloeden?
- Welk effect heeft vroeg sociaal contact op het welzijn van melkkalveren?
- Een stap dichter bij het begrijpen waarom sommige hagedissen immuun zijn voor het gif van zwarte weduwen
- De donkere kant van LED's:onderdrukking van melatonine door blauw licht
- Nieuwe beeldvormingstechniek onthult hoe mechanische schade begint op moleculaire schaal
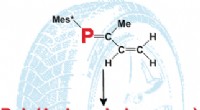
- Een chemisch functionele fosforversie van natuurlijk rubber
- Ademanalysator ter grootte van schoenendoos detecteert dodelijke longziekte sneller, nauwkeuriger dan artsen

- Een laserfocus op het vinden van betere manieren om hernieuwbare brandstoffen te maken

- Onderzoekers hopen dat een robo-neus K-9-officieren een pauze kan geven

 NASA's Hubble pauzeert de wetenschap vanwege een gyroprobleem
NASA's Hubble pauzeert de wetenschap vanwege een gyroprobleem  Observatie van gekwantiseerde verwarming in kwantummaterie
Observatie van gekwantiseerde verwarming in kwantummaterie De meeste Amerikanen onderschatten de bezorgdheid over het milieu van minderheden - zelfs minderheden
De meeste Amerikanen onderschatten de bezorgdheid over het milieu van minderheden - zelfs minderheden VN-milieuchef:VS zullen akkoord van Parijs waarschijnlijk nakomen
VN-milieuchef:VS zullen akkoord van Parijs waarschijnlijk nakomen Wat is het Haploid & diploïde celnummer voor een aap?
Wat is het Haploid & diploïde celnummer voor een aap?  Onderzoek vindt een nieuwe manier om Siri en Google Assistant te hacken met ultrasone golven
Onderzoek vindt een nieuwe manier om Siri en Google Assistant te hacken met ultrasone golven Hoe is het mogelijk dat calciumhydroxide zowel covalente als ionische bindingen heeft?
Hoe is het mogelijk dat calciumhydroxide zowel covalente als ionische bindingen heeft?  Micro-organismen verminderen de methaanuitstoot uit de oceaan
Micro-organismen verminderen de methaanuitstoot uit de oceaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

