
Wetenschap
Wat zijn producten van de reactie tussen water en natrium?
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
Hier is een meer gedetailleerde uitleg van wat er gebeurt tijdens deze reactie:
1. Natriumatomen (Na) in het metaal komen in contact met watermoleculen (H2O).
2. Omdat natriumatomen zeer elektronegatief zijn, doneren ze gemakkelijk hun buitenste elektron aan het elektronegatieve zuurstofatoom van het watermolecuul.
3. Als gevolg hiervan verandert het natriumatoom in een positief geladen natriumion (Na+) en krijgt het watermolecuul een extra elektron en wordt het hydroxide-ion (OH-).
4. Deze ionen worden vervolgens opgelost door de resterende watermoleculen, waarbij natriumhydroxide (NaOH) wordt gevormd, een sterke base die oplosbaar is in water.
5. Tegelijkertijd combineren de waterstofatomen in het watermolecuul, die nu geen elektron hebben, zich om waterstofgas (H2) te vormen.
6. Waterstofgas, dat een lagere dichtheid heeft dan water, stijgt naar de oppervlakte en kan worden waargenomen als bellen of worden opgevangen in een geschikte container.
De reactie tussen water en natrium is zeer exotherm, wat betekent dat er een aanzienlijke hoeveelheid warmte vrijkomt. Deze hitte kan ervoor zorgen dat het water kookt en een krachtige reactie veroorzaakt. Het is belangrijk op te merken dat deze reactie met voorzichtigheid en de juiste veiligheidsmaatregelen moet worden uitgevoerd, zoals het dragen van beschermende kleding en een veiligheidsbril, vanwege de ontvlambare aard van waterstofgas en de bijtende werking van natriumhydroxide.
 Metaalkatalysatoren die worden gebruikt voor milieuduurzaamheid blijken te degraderen en worden minder effectief
Metaalkatalysatoren die worden gebruikt voor milieuduurzaamheid blijken te degraderen en worden minder effectief Atomair gedispergeerd Ni is cokesbestendig voor droge reforming van methaan
Atomair gedispergeerd Ni is cokesbestendig voor droge reforming van methaan Stoffen die elektriciteit kunnen geleiden als ze zijn opgelost in water?
Stoffen die elektriciteit kunnen geleiden als ze zijn opgelost in water?  Microbieel geïnduceerde carbonaatneerslag kan grofkorrelige, zoute grond verbeteren
Microbieel geïnduceerde carbonaatneerslag kan grofkorrelige, zoute grond verbeteren Wat is de reactie van Ag2CO3 plus HNO3?
Wat is de reactie van Ag2CO3 plus HNO3?
 Opkomst en ondergang van waterblaren bieden een glimp onder de dikke ijskap van Groenland
Opkomst en ondergang van waterblaren bieden een glimp onder de dikke ijskap van Groenland Plastic dhow vaart langs de kust van Kenia om de afvalcrisis te benadrukken
Plastic dhow vaart langs de kust van Kenia om de afvalcrisis te benadrukken Orkaandelta teistert Caribische kust van Mexico
Orkaandelta teistert Caribische kust van Mexico Voor de deur:wat u koopt en waar u woont, bepaalt de voetafdruk van het landgebruik
Voor de deur:wat u koopt en waar u woont, bepaalt de voetafdruk van het landgebruik  Kunnen twee bedrijven in Georgië de plasticcrisis helpen oplossen?
Kunnen twee bedrijven in Georgië de plasticcrisis helpen oplossen?
Hoofdlijnen
- Welk enzym voegt nucleïnezuren toe aan de DNA-keten?
- Wat is het aantal chromosomen in de zygoot als voortplantingscellen of gameten er elk 12 bevatten?
- Wetenschappers ontdekken hoe bepaalde hormonen aspecten van de wortelvertakking in planten controleren
- Cellen afgeleid van verschillende stamcellen:hetzelfde of verschillend?
- Vechten of vluchten? Hoe vogels de mysteries van evolutie helpen onthullen
- Nieuwe functies voor 'junk'-DNA?
- Hoe leden van het microbioom specifiek Salmonella-infecties bestrijden
- Onderzoek onderzoekt hoe een sleutelgen het terpeenaroma in druiven moduleert
- Nieuwe hypothese:waarom bacteriën steeds resistenter worden tegen antibiotica
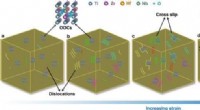
- Verbeterde sterkte en taaiheid in een legering met hoge entropie via geordende zuurstofcomplexen
- COVID-19:een wake-up call om de toeleveringsketen van geneesmiddelen opnieuw in evenwicht te brengen?

- Pesticiden dodelijk voor bijen nu gemakkelijk te detecteren in honing

- Slimmer verwarmen, niet moeilijker:hoe microgolven katalytische reacties efficiënter maken

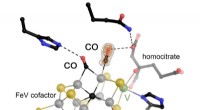
- Vanadiumafhankelijke stikstofase kan twee CO-moleculen tegelijk binden
 Onderzoekers maken organische zonnecellen immuun voor de verwoestingen van water, lucht en licht
Onderzoekers maken organische zonnecellen immuun voor de verwoestingen van water, lucht en licht Als gevolg van de klimaatverandering kunnen catastrofale bosbranden in Australië elk moment toeslaan
Als gevolg van de klimaatverandering kunnen catastrofale bosbranden in Australië elk moment toeslaan  Hoe stedelijke hitte de bijenpopulaties beïnvloedt
Hoe stedelijke hitte de bijenpopulaties beïnvloedt  Een groot deel van de energie ter wereld komt van fossiele brandstoffen. Kunnen we alles vervangen door hernieuwbare energie?
Een groot deel van de energie ter wereld komt van fossiele brandstoffen. Kunnen we alles vervangen door hernieuwbare energie? Berekening van boombasalgebied
Berekening van boombasalgebied Wat is de volgorde van de planeten van de heetste tot de koudste?
Wat is de volgorde van de planeten van de heetste tot de koudste?  Oceaanmicroben kunnen interageren met vervuiling om het klimaat te beïnvloeden
Oceaanmicroben kunnen interageren met vervuiling om het klimaat te beïnvloeden Wat veroorzaakt de kleurverandering en neerslag in water?
Wat veroorzaakt de kleurverandering en neerslag in water?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

