
Wetenschap
Eigenlijk is de koolstofvalentie geschreven als 1s2 2s2 2p2. Waarom is dit niet schrijf 2s1 2p3?
In de notatie die je hebt opgegeven, 1s2 2s2 2p2, zijn alle drie de valentieschilorbitalen (2s en drie 2p-orbitalen) volledig gevuld met elektronen. Deze configuratie zou resulteren in een stabiele edelgasconfiguratie, maar dit is niet het geval voor koolstof. Koolstof heeft slechts vier valentie-elektronen (twee in de 2s-orbitaal en twee in de 2p-orbitalen), en het moet elektronen winnen of verliezen om een stabiele configuratie te bereiken.
De juiste notatie, 1s2 2s2 2p2 1p1, geeft aan dat koolstof twee elektronen heeft in de 1s-orbitaal, twee elektronen in de 2s-orbitaal, twee elektronen in twee van de 2p-orbitalen en één elektron in de resterende 2p-orbitaal. Deze configuratie vertegenwoordigt de aangeslagen toestand van koolstof, waarbij een van de 2p-elektronen wordt gepromoveerd naar een hoger energieniveau. Dit ongepaarde elektron in de 2p-orbitaal is verantwoordelijk voor de chemische reactiviteit van koolstof en zijn vermogen om covalente bindingen met andere atomen te vormen.
Daarom wordt de elektronische configuratie van koolstof nauwkeurig weergegeven als 1s2 2s2 2p2 1p1, wat de vierwaardige aard ervan aantoont en de neiging om bindingen te vormen om een stabiele edelgasconfiguratie te bereiken.
Hoofdlijnen
- Mitochondria-afweer van dieren ontdekt in planten
- De chaos van narwalgedrag ophelderen
- Worden je hersenen moe zoals de rest van je lichaam?
- Hoe wordt DNA-splitsing gebruikt in de biotechnologie?
- Hoe Varroamijten profiteren van beheerde bijenteeltpraktijken
- Het veranderen van de inheemse vegetatiewetten om verbranding op privéterrein mogelijk te maken, is een goed brandbeheer, zeggen Australische onderzoekers
- Wat zal GLAST ons vertellen?
- Wat bevat GEEN structureel eiwit?
- Onderzoekers ontdekken dat de celcortex wordt geactiveerd door duizenden kortlevende eiwitcondensaten
- Nieuwe theorie laat zien hoe spanning zorgt voor betere katalysatoren
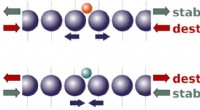
- Onderzoekers ontrafelen de actieve fase in katalytische reductie van kooldioxide tot methanol
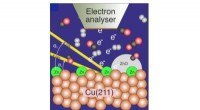
- In de brandstofcel:beeldvormingsmethode belooft industrieel inzicht

- Nieuw ontworpen molecuul bindt stikstof
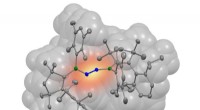
- Mixed and matched:Integratie van metaal-organische raamwerken in polymeren voor kooldioxideafscheiding

 Hoe ruimtestormen treinsignalen verkeerd interpreteren
Hoe ruimtestormen treinsignalen verkeerd interpreteren  Grafeen gebruiken om water te filteren
Grafeen gebruiken om water te filteren Schadelijke apps infecteren 25 miljoen Android-apparaten met Agent Smith-malware
Schadelijke apps infecteren 25 miljoen Android-apparaten met Agent Smith-malware Hoeveel kobalt kan er in de VS worden gewonnen? Studie onderzoekt de binnenlandse mijnsite Idaho
Hoeveel kobalt kan er in de VS worden gewonnen? Studie onderzoekt de binnenlandse mijnsite Idaho  Nederrijn verdiept Duitse energiecrisis
Nederrijn verdiept Duitse energiecrisis Hoe verander je ongepaste breuken in gemengde getallen in de vierde klas
Hoe verander je ongepaste breuken in gemengde getallen in de vierde klas  Het Europees Hof voor de Rechten van de Mens is teruggevallen op het gebied van de wettelijke bescherming van asielzoekers, zegt een studie
Het Europees Hof voor de Rechten van de Mens is teruggevallen op het gebied van de wettelijke bescherming van asielzoekers, zegt een studie  Veiligheidsregels voor een Sharp Object Lab
Veiligheidsregels voor een Sharp Object Lab
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


