Wetenschap
Wat is het verschil tussen een gehydrateerd zout en een watervrij zout?
*Bevatten watermoleculen die zijn afgestemd op het metaalion.
* De watermoleculen worden op hun plaats gehouden door waterstofbinding aan het metaalion en aan elkaar.
* Het aantal watermoleculen dat is gecoördineerd met het metaalion wordt het hydratatiegetal genoemd.
*Gehydrateerde zouten zijn doorgaans beter oplosbaar in water dan watervrije zouten.
* Voorbeelden van gehydrateerde zouten zijn koper(II)sulfaatpentahydraat (CuSO₄·5H₂O) en natriumchloridedihydraat (NaCl·2H₂O).
Watervrije zouten:
*Bevat geen watermoleculen die gecoördineerd zijn met het metaalion.
* Watervrije zouten zijn doorgaans minder oplosbaar in water dan gehydrateerde zouten.
* Voorbeelden van watervrije zouten zijn koper(II)sulfaat (CuSO₄) en natriumchloride (NaCl).
Het verschil tussen gehydrateerde zouten en watervrije zouten is te wijten aan de aanwezigheid of afwezigheid van watermoleculen die zijn gecoördineerd met het metaalion. Dit kan een aanzienlijke impact hebben op de fysische en chemische eigenschappen van het zout, zoals de oplosbaarheid, kleur en smeltpunt.
 Wil je een sterker biologisch afbreekbaar plastic? Voeg een ‘snuifje’ roomwijnsteen toe
Wil je een sterker biologisch afbreekbaar plastic? Voeg een ‘snuifje’ roomwijnsteen toe  Onderzoekers ontdekken kritische metabole schakelaar voor ontstekingsziekten
Onderzoekers ontdekken kritische metabole schakelaar voor ontstekingsziekten Zuurdesembrood Hoe werkt het?
Zuurdesembrood Hoe werkt het?  Verbeterde fotosynthese van ammoniak in de omgeving met behulp van nanosheets met lichtschakelbare zuurstofvacatures
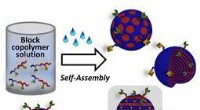
Verbeterde fotosynthese van ammoniak in de omgeving met behulp van nanosheets met lichtschakelbare zuurstofvacatures veiliger, duurzamere energieopslag vereist focus op interface van geavanceerde materialen
veiliger, duurzamere energieopslag vereist focus op interface van geavanceerde materialen
 Hoe oceanen en atmosferen warmte verplaatsen op aarde en andere planetaire lichamen
Hoe oceanen en atmosferen warmte verplaatsen op aarde en andere planetaire lichamen Mediterrane orkanen zullen naar verwachting tegen het einde van de eeuw in kracht toenemen
Mediterrane orkanen zullen naar verwachting tegen het einde van de eeuw in kracht toenemen NASA-NOAA-satelliet volgt een sterkere tropische cycloon Owen die aan land komt
NASA-NOAA-satelliet volgt een sterkere tropische cycloon Owen die aan land komt Oceaanbossen:hoe 'drijvende' mangroven een breed scala aan ecologische en sociale voordelen kunnen bieden
Oceaanbossen:hoe 'drijvende' mangroven een breed scala aan ecologische en sociale voordelen kunnen bieden  Slak Aanpassing aan Habitat
Slak Aanpassing aan Habitat
Hoofdlijnen
- Wat maakt ons mens?
- De vondst van zijn leven:8-jarige jongen ontdekt gigantische haaientand in South Carolina
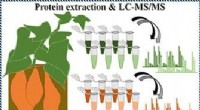
- Uit onderzoek blijkt dat er minder schimmelgifstoffen aanwezig zijn in biologisch geteeld graan, vergeleken met conventioneel geteeld graan
- Bereidheid om risico's te nemen - een persoonlijkheidskenmerk
- In vijverschuim, wetenschappers vinden antwoorden op een evolutie die het eerst kwam gevallen
- Hoe we een zeldzaam gigantisch duizendpootfossiel ontdekten op een strand, en waarom het ertoe doet
- Evolutionair gewasonderzoek:Egoplanten geven lagere opbrengst
- Nieuwe vliegsoort in Central Park krijgt bijnaam CCNY-professoren
- Bultrugwalvissen verspreidden zich van pod tot pod over de Stille Oceaan
 Ophoping van organische stof in zuurstofrijke meren
Ophoping van organische stof in zuurstofrijke meren Natuurkundigen breiden stochastische thermodynamica dieper uit in het kwantumterritorium
Natuurkundigen breiden stochastische thermodynamica dieper uit in het kwantumterritorium Gebruik maken van de diva's van de nanowereld
Gebruik maken van de diva's van de nanowereld Hoe een P-waarde te berekenen
Hoe een P-waarde te berekenen  De temperaturen in april in Bangladesh zijn het hoogst ooit gemeten
De temperaturen in april in Bangladesh zijn het hoogst ooit gemeten  Eucalyptus krijgt de hak op de tak na dodelijke bosbranden in Portugal
Eucalyptus krijgt de hak op de tak na dodelijke bosbranden in Portugal Hoe de Azteken de moderne stadslandbouw konden verbeteren
Hoe de Azteken de moderne stadslandbouw konden verbeteren Hoe bacteriële cellen hun eigen DNA herkennen
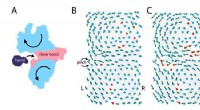
Hoe bacteriële cellen hun eigen DNA herkennen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com