
Wetenschap
Wat zijn zwakke bindingen die niet sterk genoeg zijn om atomen bij elkaar te houden in moleculen, maar binnen en rond grote moleculen?
1. Van der Waals-krachten:
- Van der Waals-krachten zijn de zwakste van de intermoleculaire krachten en komen voor tussen alle moleculen.
- Ze bestaan uit drie componenten:
- Londense dispersiekrachten:dit zijn tijdelijke aantrekkingskrachten die ontstaan als gevolg van de fluctuaties in de elektronenverdeling in moleculen.
- Dipool-geïnduceerde dipoolkrachten:deze krachten treden op wanneer een permanente dipool in één molecuul een tijdelijke dipool induceert in een naburig molecuul.
- Permanente dipool-permanente dipoolkrachten:deze krachten treden op tussen moleculen met permanente dipolen.
2. Waterstofobligaties:
- Waterstofbruggen zijn sterke dipool-dipoolinteracties die plaatsvinden tussen een zeer elektronegatief atoom (meestal F, O of N) en een waterstofatoom dat covalent gebonden is aan een ander zeer elektronegatief atoom.
- Waterstofbruggen zijn sterker dan van der Waals-krachten, maar zwakker dan covalente bindingen.
3. Dipool-dipoolinteracties:
- Dipool-dipoolinteracties vinden plaats tussen moleculen met permanente dipolen. Het positieve uiteinde van de ene dipool wordt aangetrokken door het negatieve uiteinde van een andere dipool, wat resulteert in een netto aantrekkingskracht.
4. Ionische interacties:
- Ionische interacties zijn elektrostatische krachten tussen positief geladen ionen (kationen) en negatief geladen ionen (anionen).
- Ionische interacties zijn sterker dan waterstofbruggen en dipool-dipoolinteracties, maar zwakker dan covalente bindingen.
 Hoe gaan de straatverlichting 's nachts automatisch aan?
Hoe gaan de straatverlichting 's nachts automatisch aan?  Gevaarlijke klimaatverandering is waarschijnlijk, concludeert nieuw onderzoek
Gevaarlijke klimaatverandering is waarschijnlijk, concludeert nieuw onderzoek De stranden van Tel Aviv vallen tegen in Israëls passie voor plastic
De stranden van Tel Aviv vallen tegen in Israëls passie voor plastic Gezondheidszorg is verantwoordelijk voor 7% van de CO2-uitstoot en er zijn veilige en gemakkelijke manieren om deze te verminderen
Gezondheidszorg is verantwoordelijk voor 7% van de CO2-uitstoot en er zijn veilige en gemakkelijke manieren om deze te verminderen Zware stormen teisteren Polen, 2 doden en 39 gewonden achterlatend
Zware stormen teisteren Polen, 2 doden en 39 gewonden achterlatend
Hoofdlijnen
- Begrijpen hoe cellen elektrische velden volgen
- Bijensteken, onderzoek waarvan je denkt:'huh?' win Ig Nobels (update)
- Videobeelden bieden eerste gedetailleerde observatie van orka's die op witte haaien jagen in Zuid-Afrika
- Hoeveel menselijke genetische aandoeningen zijn er bekend?
- Hoe je een groeiende bevolking gezond voedsel kunt geven zonder de planeet te ruïneren
- Wat doet SDS met cellen?
- Zat Darwinius iets langer in de tand dan eerder werd gedacht?
- Nieuwe Japanse leliesoort geïdentificeerd, eerste toevoeging aan de sukashiyuri-groep in 110 jaar
- Welke niet-levende wezens bestuderen mariene biologen?
- Beeldvormingstechniek geeft katalytische 2D-materiaaltechniek een beter zicht
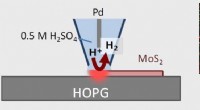
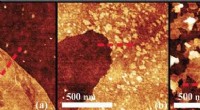
- Verbeterd begrip van baanbrekende vloeibaar-metaal 2D-techniek
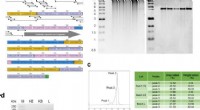
- Recombinant collageenpolypeptide als een veelzijdig biomateriaal voor bottransplantaten
- Rioolschat:ingenieurs onthullen hoe ze processen kunnen optimaliseren voor het omzetten van zwavel in afvalwater in waardevolle materialen

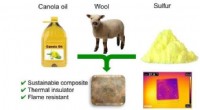
- Nieuwe isolatie haalt warmte uit de omgeving
 Een Europese missiecontrole voor de Marsrover
Een Europese missiecontrole voor de Marsrover Welke dieren eten klaver?
Welke dieren eten klaver?  Regen en damafvoer veroorzaken overstromingen in het zuiden van Mexico
Regen en damafvoer veroorzaken overstromingen in het zuiden van Mexico Geavanceerde series van robuustere drones leren zichzelf vliegen
Geavanceerde series van robuustere drones leren zichzelf vliegen Wetenschappers stemmen af op protonspin-precessie
Wetenschappers stemmen af op protonspin-precessie Juist gebrekkige nanodiamanten zouden de volgende generatie hulpmiddelen voor beeldvorming en communicatie kunnen opleveren
Juist gebrekkige nanodiamanten zouden de volgende generatie hulpmiddelen voor beeldvorming en communicatie kunnen opleveren Helpt of schaadt transparantie bedrijven die worden gedomineerd door eenmalige transacties?
Helpt of schaadt transparantie bedrijven die worden gedomineerd door eenmalige transacties?  Eerste bevestigde foto van pasgeboren planeet gevangen met ESO's VLT
Eerste bevestigde foto van pasgeboren planeet gevangen met ESO's VLT
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

