
Wetenschap
Bij de reactie tussen het broom- en het natriumatoom ontstaat er een elektron dat het bromide-ion vormt. Wat gebeurt er met broom?
Wanneer een natriumatoom reageert met een broomatoom, verliest het natriumatoom een elektron aan het broomatoom, waardoor een natriumion en een bromide-ion worden gevormd. Het elektron dat wordt overgedragen van het natriumatoom naar het broomatoom vult de buitenste elektronenschil van het broomatoom, waardoor het een stabiel ion wordt.
$$Na(g) + Br_2(g) \longrightarrow Na^+(g) + 2Br^{-}(g)$$
Bij deze reactie wordt het natriumatoom geoxideerd omdat het een elektron verliest, terwijl het broomatoom wordt gereduceerd omdat het een elektron krijgt.
 Wat is de formule voor een ionische verbinding die drie ijzerionen en oxide-ionen bevat?
Wat is de formule voor een ionische verbinding die drie ijzerionen en oxide-ionen bevat?  Welk element heeft een elektronenrangschikking van 2882?
Welk element heeft een elektronenrangschikking van 2882?  Ode aan een fibrinepolymeer - Hoe het vers van een student het klinische chemietijdschrift haalde
Ode aan een fibrinepolymeer - Hoe het vers van een student het klinische chemietijdschrift haalde  Wat kost diamantzuiverheid?
Wat kost diamantzuiverheid?  Welke heeft een grotere dichtheid:1 kg platina of 3 kg goud?
Welke heeft een grotere dichtheid:1 kg platina of 3 kg goud?
Hoofdlijnen
- Relatie tussen celstructuur en functie
- Wat hebben wetenschappers geleerd van experimenten die zijn ontworpen om de hypothese te testen dat leven uit niet-levende materialen is ontstaan?
- Welke organellen bevinden zich in een wortelcel?
- De in 1995 opgegraven Plesiosaurus bleek een langnekkig zeereptiel te zijn
- Namen van de structurele componenten van het menselijk hart
- Stoned Ape Theory:magische paddestoelen en menselijke evolutie
- Uit onderzoek blijkt hoe bacteriën zich verzetten tegen een 'Trojaans paard'-antibioticum
- Slapen spinnen? Uit onderzoek blijkt dat ze net als mensen kunnen dutten
- Vindt fotosynthese plaats in een plant of dier?
- Hoe potentieel schadelijke vrije radicalen in sigarettenrook te meten?

- De eiwitpatrouilles volgen
- Onderzoekers ontdekken zeer actieve organische fotokatalysator
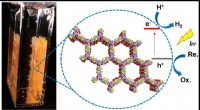
- Een reactie waarbij licht en twee overgangsmetaalkatalysatoren worden gebruikt om anilinen te maken

- Enorm potentieel voor elektronisch textiel gemaakt met nieuwe cellulosedraad

 Canada stimuleert kernenergie om klimaatdoelstelling te helpen halen
Canada stimuleert kernenergie om klimaatdoelstelling te helpen halen Hoe Salmonella zijn invasieplan synchroniseert
Hoe Salmonella zijn invasieplan synchroniseert  Onderzoekers zeggen dat 2D-borium het beste is voor flexibele elektronica
Onderzoekers zeggen dat 2D-borium het beste is voor flexibele elektronica Wat is de maximale vergroting voor een rasterelektronenmicroscoop?
Wat is de maximale vergroting voor een rasterelektronenmicroscoop?  Voorkeur voor bemonstering kan het beeld van onrust als gevolg van de opwarming van de aarde vertekenen
Voorkeur voor bemonstering kan het beeld van onrust als gevolg van de opwarming van de aarde vertekenen Nieuwe inzichten in het toxine achter tetanus
Nieuwe inzichten in het toxine achter tetanus Afbeelding:X-ray serendipiteit
Afbeelding:X-ray serendipiteit Hoogste gehalte aan microplastics in weekdieren, nieuwe studie zegt
Hoogste gehalte aan microplastics in weekdieren, nieuwe studie zegt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

