
Wetenschap
Waarom heeft zwaveldioxide een laag smeltpunt?
1. Moleculaire structuur: Zwaveldioxide is een klein, niet-polair molecuul met een gebogen moleculaire geometrie. Het molecuul bestaat uit één zwavelatoom dat covalent gebonden is aan twee zuurstofatomen. Het elektronegativiteitsverschil tussen zwavel- en zuurstofatomen is relatief klein, wat resulteert in een zwakke polaire covalente binding. Deze zwakke polariteit leidt tot minder significante intermoleculaire krachten tussen zwaveldioxidemoleculen.
2. Zwakke van der Waals-krachten: De overheersende intermoleculaire krachten die aanwezig zijn in zwaveldioxide zijn van der Waals-krachten, met name de Londense dispersiekrachten. Deze krachten komen voort uit tijdelijke fluctuaties in de elektronendichtheid, waardoor onmiddellijke dipolen ontstaan. Vanwege de symmetrische aard van de moleculaire structuur van zwaveldioxide en de lage polariseerbaarheid van de atomen zijn de Londense dispersiekrachten tussen de moleculen echter zwak.
3. Laag molecuulgewicht: Zwaveldioxide heeft een relatief laag molecuulgewicht van 64,07 g/mol. De sterkte van de Van der Waals-krachten neemt over het algemeen toe met toenemend molecuulgewicht. Omdat zwaveldioxide een laag molecuulgewicht heeft, zijn de aantrekkingskrachten tussen de moleculen zwakker, wat bijdraagt aan het lagere smeltpunt.
In tegenstelling tot zwaveldioxide hebben stoffen met sterkere intermoleculaire krachten, zoals waterstofbinding, ionische binding of sterkere dipool-dipoolkrachten, doorgaans hogere smeltpunten. De zwakke van der Waals-krachten en het lage molecuulgewicht van zwaveldioxide resulteren in een relatief laag smeltpunt vergeleken met andere verbindingen met vergelijkbare molecuulgewichten.
 Iedereen zit buiten:Yangon-parken bieden hittegolfverlichting
Iedereen zit buiten:Yangon-parken bieden hittegolfverlichting  Italiaanse Alpengletsjer bijna ingestort, ambtenaren waarschuwen
Italiaanse Alpengletsjer bijna ingestort, ambtenaren waarschuwen Milieurechtvaardigheid verdedigers slachtoffers van geweld en moord
Milieurechtvaardigheid verdedigers slachtoffers van geweld en moord Wat kinderen ons kunnen leren over zorg voor het milieu
Wat kinderen ons kunnen leren over zorg voor het milieu Waarom de wereld slimmer moet worden over waterverbruik
Waarom de wereld slimmer moet worden over waterverbruik
Hoofdlijnen
- Onderzoekers ontcijferen hoe een enzym het genetisch materiaal in de celkern wijzigt
- Onderzoekers onthullen de evolutionaire oorsprong van eetlust door het eenvoudige zenuwstelsel van Hydra te bestuderen
- Hoe microbiële interacties ons leven vormgeven
- Helpers bij het nest kunnen moedervogels toestaan kleinere eieren te leggen
- Hoe reset de lichaamstemperatuur de biologische klok?
- Hoe pathogene bacteriën de slingers en pijlen van infectie doorstaan
- Waarom restaurants willen dat je eten bestelt op je telefoon
- Het bestuderen van circadiane ritmes in planten en hun ziekteverwekkers kan leiden tot precisiegeneeskunde voor mensen
- Biologische en conventionele melk:appels met appels vergelijken?
- Eco-lijm kan schadelijke lijmen in houtconstructies vervangen

- Video:Waarom Antarctische vissen niet doodvriezen

- Chemici bedenken een manier om microplastics te verwijderen met okra

- Snelle manier om moleculaire kooien te maken, kan het zoeken naar nieuwe materialen vernieuwen
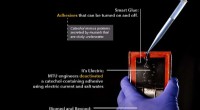
- Ingenieurs zappen en maken onderwater slimme lijm los
 Onderzoeken met neutronen beslechten wetenschappelijk geschil over de structuur van fluor
Onderzoeken met neutronen beslechten wetenschappelijk geschil over de structuur van fluor AT&T-chef zegt dat fusie de waarde van Time Warner zou vergroten
AT&T-chef zegt dat fusie de waarde van Time Warner zou vergroten Hoe ontstaat grafeen?
Hoe ontstaat grafeen?  Review:Death Stranding is Oregon Trail met omwegen door de verbeelding van Kojimas
Review:Death Stranding is Oregon Trail met omwegen door de verbeelding van Kojimas Continue rolprocestechnologie voor het overbrengen en verpakken van flexibele LSI
Continue rolprocestechnologie voor het overbrengen en verpakken van flexibele LSI Britse experts waarschuwen voor maatregelen tegen klimaatwetenschap door Trump
Britse experts waarschuwen voor maatregelen tegen klimaatwetenschap door Trump Beheer van aardbevingen veroorzaakt door olieproductie:wetenschappers demonstreren een veiligere methode voor de verwijdering van afvalwater
Beheer van aardbevingen veroorzaakt door olieproductie:wetenschappers demonstreren een veiligere methode voor de verwijdering van afvalwater Koffie malen met een scheutje water vermindert de statische elektriciteit en zorgt voor een consistentere en intensere espresso:studeren
Koffie malen met een scheutje water vermindert de statische elektriciteit en zorgt voor een consistentere en intensere espresso:studeren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

