
Wetenschap
Waarom is het moeilijk om zeep in een zure oplossing te gebruiken?
Zeepmoleculen zijn samengesteld uit een lange koolwaterstofketen met een negatief geladen kopgroep. In een waterige oplossing vormen zeepmoleculen micellen, dit zijn bolvormige aggregaten waarbij de koolwaterstofketens naar binnen wijzen en de kopgroepen naar buiten wijzen. Deze micellen kunnen vuil- en oliemoleculen opvangen, waardoor ze met water kunnen worden weggespoeld.
In een zure oplossing is de pH van de oplossing lager dan 7, wat betekent dat er meer waterstofionen (H+) in de oplossing zitten dan hydroxide-ionen (OH-). De H+-ionen kunnen reageren met de zeepmoleculen, waardoor de lading op de kopgroepen wordt geneutraliseerd. Hierdoor vallen de micellen uiteen, waardoor de vuil- en oliemoleculen weer in de oplossing terechtkomen. Als gevolg hiervan is zeep niet zo effectief bij het reinigen in een zure oplossing als in een neutrale of basische oplossing.
 Eén atmosferische verbinding is, nadat deze in water is opgelost, verantwoordelijk voor zowel de algemene zuurgraad van normaal regenwater als van veel grond. Wat is deze verbinding?
Eén atmosferische verbinding is, nadat deze in water is opgelost, verantwoordelijk voor zowel de algemene zuurgraad van normaal regenwater als van veel grond. Wat is deze verbinding?  Een belangrijke stap in de fotosynthetische zuurstofproductie ontrafelen
Een belangrijke stap in de fotosynthetische zuurstofproductie ontrafelen Is vaseline oplosbaar in water?
Is vaseline oplosbaar in water?  De groene revolutie naar elektronica brengen
De groene revolutie naar elektronica brengen Onderzoekers tonen effectiviteit nieuwe niet-invasieve bloedglucosetest aan
Onderzoekers tonen effectiviteit nieuwe niet-invasieve bloedglucosetest aan
 Rol van beton bij het verminderen van emissies van gebouwen en bestrating
Rol van beton bij het verminderen van emissies van gebouwen en bestrating CO2-uitstoot neemt weer toe, maar schone energierevoluties zijn in opkomst
CO2-uitstoot neemt weer toe, maar schone energierevoluties zijn in opkomst Regels om het brandstofverbruik van voertuigen te verhogen zullen meer goed dan kwaad doen, nieuwe studie toont
Regels om het brandstofverbruik van voertuigen te verhogen zullen meer goed dan kwaad doen, nieuwe studie toont Wat voor soort huis zou de boom bieden?
Wat voor soort huis zou de boom bieden?  Opwarming van het Russische noordpoolgebied leidt tot groot ijsverlies
Opwarming van het Russische noordpoolgebied leidt tot groot ijsverlies
Hoofdlijnen
- Hoe reageert het immuunsysteem op veranderde zwaartekracht?
- Een macromolecuul dat zichzelf kan kopiëren en eiwitten kan maken, wat is dat?
- Waarschijnlijke voorouder van alle geïdentificeerde moderne hoefdieren
- Hoe komen de spermacellen in een stuifmeelkorrel aan bij de eicelklus in een plant-ovule?
- Hoe planten oxidatieve stress voorkomen
- De herstellende populatie Zimbabwaanse Afrikaanse leeuwen vertoont een lage genetische diversiteit
- Hoe geel en blauw groen maken bij papegaaien
- Nieuwsgierige grote witte haai speelt met camera
- Videobeelden bieden eerste gedetailleerde observatie van orka's die op witte haaien jagen in Zuid-Afrika
- Onderzoek geeft nieuw lichtpuntje voor zonnebrandstof

- Wetenschappers laten zien hoe ze een katalysator kunnen beheersen die een broeikasgas in een brandstof of grondstof verandert
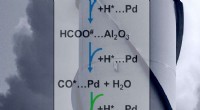
- Nieuw materiaal met sterke werking tegen schimmels en tumoren ontwikkeld
- Actie van geneesmiddelverbindingen in weefsel onthuld door nieuwe techniek
- Gefuseerde beeldvorming onthult zesde-eeuws schrift verborgen in boekbinden

 Is er een rijm of reden voor de manier waarop Amerikaanse snelwegen zijn genummerd?
Is er een rijm of reden voor de manier waarop Amerikaanse snelwegen zijn genummerd?  Insecteneiwit heeft een groot potentieel om de ecologische voetafdruk van Europese consumenten te verkleinen
Insecteneiwit heeft een groot potentieel om de ecologische voetafdruk van Europese consumenten te verkleinen Studie onderzoekt hoe spin-baan interactie Majorana nanodraden beschermt
Studie onderzoekt hoe spin-baan interactie Majorana nanodraden beschermt Waarom hebben kleine veranderingen in de temperatuur op aarde een grote impact?
Waarom hebben kleine veranderingen in de temperatuur op aarde een grote impact?  Bacteriën gedood door nieuwe door licht geactiveerde coating
Bacteriën gedood door nieuwe door licht geactiveerde coating Techniek vist waardevolle voedingsstoffen uit garnalenverwerkingswater
Techniek vist waardevolle voedingsstoffen uit garnalenverwerkingswater Ingenieurs ontwikkelen onzichtbaarheidsmantel voor hightech verwerkingschips
Ingenieurs ontwikkelen onzichtbaarheidsmantel voor hightech verwerkingschips Voyage 2050 zet koers:ESA kiest thema's voor toekomstige wetenschappelijke missies
Voyage 2050 zet koers:ESA kiest thema's voor toekomstige wetenschappelijke missies
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

