
Wetenschap
Bepaal de pH van een 5 M HA-oplossing bij 25 graden Ka 7,1 x 10-4?
$$pH =pK_a + log\frac{[A^-]}{[HA]}$$
waarbij pKa de negatieve logaritme is van de zuurdissociatieconstante (Ka), [A-] de concentratie van de geconjugeerde base is en [HA] de concentratie van het zwakke zuur is.
Als we de gegeven waarden in de vergelijking vervangen, krijgen we:
$$pH =-log(7,1 \times 10^{-4}) + log\frac{0}{5}$$
Omdat de concentratie van de geconjugeerde base [A-] aanvankelijk 0 is, wordt de logterm -∞
$$pH =3,15 - ∞$$
Daarom kan de pH van de 5 M HA-oplossing bij 25 graden Celsius niet worden bepaald met behulp van de Henderson-Hasselbalch-vergelijking, aangezien de concentratie van de geconjugeerde base nul is, wat resulteert in een ongedefinieerde pH-waarde.
 Wat is het oxidatiegetal van elk atoom in S2Cl2?
Wat is het oxidatiegetal van elk atoom in S2Cl2?  Als rode lakmoes aan een alkali wordt toegevoegd?
Als rode lakmoes aan een alkali wordt toegevoegd?  PFAS, PFAS overal:hoe ongerept zijn laboratoriummaterialen?
PFAS, PFAS overal:hoe ongerept zijn laboratoriummaterialen?  Hoe kan het tegenstroomuitwisselingsmechanisme de snelheid van zuurstof verhogen?
Hoe kan het tegenstroomuitwisselingsmechanisme de snelheid van zuurstof verhogen?  Genetica-inspanningen die de voeding van popcorn verrijken, sorghum
Genetica-inspanningen die de voeding van popcorn verrijken, sorghum
 een 20, Olieramp van 000 ton vervuilt het noordpoolgebied - het kan tientallen jaren duren om op te ruimen
een 20, Olieramp van 000 ton vervuilt het noordpoolgebied - het kan tientallen jaren duren om op te ruimen Oude klimaatverandering veroorzaakte opwarming die duizenden jaren duurde
Oude klimaatverandering veroorzaakte opwarming die duizenden jaren duurde Hoe beter ondergedoken vegetatie zich ontwikkelt, de grotere stikstofverwijdering vindt plaats in meersedimenten
Hoe beter ondergedoken vegetatie zich ontwikkelt, de grotere stikstofverwijdering vindt plaats in meersedimenten Hittegolf werd veroorzaakt door klimaatverandering, volgens nieuw onderzoek
Hittegolf werd veroorzaakt door klimaatverandering, volgens nieuw onderzoek Studieprojecteert een golf van overstromingen langs de kust vanaf 2030
Studieprojecteert een golf van overstromingen langs de kust vanaf 2030
Hoofdlijnen
- Kunnen dieren iriserende kleuren gebruiken om te communiceren?
- Wetenschappers identificeren sleutelfactoren die microben helpen gedijen in ruwe omgevingen
- De structuur van een eukaryote cel
- Hoe een weekdier gevonden in de Florida Keys je in de gevangenis kan zetten
- Computersimulaties werpen licht op hoe immuuncellen vreemde antigenen identificeren
- Wat is de definitie van organsim?
- Als je jezelf zou kunnen klonen, zou je dan nog steeds seks hebben?
- Hoe transcriptie epigenetische silencing oplevert
- Nieuwe studie ontdekt klein doelwit op RNA om ontstekingen te kortsluiten
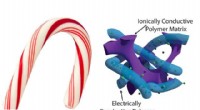
- Supercondensator met snoepriet kan snel opladen van mobiele telefoons mogelijk maken
- Geurafgevende stof kan zweterige gymkleding helpen neutraliseren
- Cement, zout en water:een nieuw opslagmateriaal voor groene warmte

- De baanbrekende techniek van scheikundigen in Miami maakt ontwerpen mogelijk op het grensvlak van scheikunde en biologie
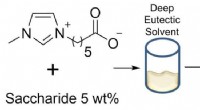
- Nieuwe oplosmiddelen om plantaardige cellulose af te breken voor bio-ethanol
 LHAASO ontdekt een gigantische gammastralingsbel met ultrahoge energie, waarmee de eerste super PeVatron wordt geïdentificeerd
LHAASO ontdekt een gigantische gammastralingsbel met ultrahoge energie, waarmee de eerste super PeVatron wordt geïdentificeerd  Onderzoek suggereert dat hittegolven van de toekomst miljoenen kunnen doden
Onderzoek suggereert dat hittegolven van de toekomst miljoenen kunnen doden Voorbij grafeen:controlerende eigenschappen van 2D-materialen
Voorbij grafeen:controlerende eigenschappen van 2D-materialen Power Felt gebruikt lichaamswarmte om elektriciteit op te wekken
Power Felt gebruikt lichaamswarmte om elektriciteit op te wekken Hoe de vierkante voet van een cirkel te berekenen
Hoe de vierkante voet van een cirkel te berekenen  De voordelen van desalination
De voordelen van desalination World View Enterprises die het gebruik van stratosferische ballonnen populair willen maken
World View Enterprises die het gebruik van stratosferische ballonnen populair willen maken Mercurius:snel,
Mercurius:snel,
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

