
Wetenschap
Wat maakt iets tot een zuur en wat geeft het af in water?
Een stof reageert als een zuur als:
- Geeft waterstofionen af wanneer opgelost in water
- Wordt blauw lakmoesrood
- Smaakt zuur
- Reageert met metalen zoals Zn, waarbij brandbaar waterstofgas vrijkomt
Zuren geven waterstofionen (H+) vrij in water. Dit komt door de polaire aard van watermoleculen. Het zuurstofatoom in water heeft een gedeeltelijke negatieve lading, terwijl het waterstofatoom een gedeeltelijke positieve lading heeft. Door deze polariteit kunnen watermoleculen zuurmoleculen afbreken, waardoor ze H+-ionen vrijgeven.
De sterkte van een zuur wordt bepaald door zijn vermogen om H+-ionen af te staan. Hoe gemakkelijker een zuur H+-ionen afstaat, hoe sterker het is. Zuren worden geclassificeerd als sterk of zwak op basis van hun mate van ionisatie in water.
- Sterke zuren volledig dissociëren in water, waarbij al hun H+-ionen vrijkomen. Voorbeelden van sterke zuren zijn zoutzuur (HCl), zwavelzuur (H2SO4) en salpeterzuur (HNO3).
- Zwakke zuren dissociëren slechts gedeeltelijk in water, waarbij slechts een klein deel van hun H+-ionen vrijkomt. Voorbeelden van zwakke zuren zijn azijnzuur (CH3COOH), koolzuur (H2CO3) en fosforzuur (H3PO4).
De pH-schaal wordt gebruikt om de zuurgraad of basiciteit van een oplossing te meten. De pH-schaal loopt van 0 tot 14, waarbij 7 neutraal is. Oplossingen met een pH lager dan 7 zijn zuur, terwijl oplossingen met een pH hoger dan 7 basisch zijn.
 Wat is de ideale gaswet?
Wat is de ideale gaswet?  Chemici laten zien dat het 18-elektronenprincipe niet beperkt is tot overgangsmetalen
Chemici laten zien dat het 18-elektronenprincipe niet beperkt is tot overgangsmetalen  Bacteriefabrieken kunnen hoogwaardige eiwitten maken voor ruimtemissies
Bacteriefabrieken kunnen hoogwaardige eiwitten maken voor ruimtemissies Een veelbelovende doorbraak voor een beter ontwerp van elektronische materialen
Een veelbelovende doorbraak voor een beter ontwerp van elektronische materialen Door goedkope en veilige zwart-witte materialen te combineren, ontstaan kleurrijke pigmenten
Door goedkope en veilige zwart-witte materialen te combineren, ontstaan kleurrijke pigmenten
Hoofdlijnen
- Ozonvervuiling bedreigt de gezondheid van planten en maakt het voor bestuivers moeilijker om bloemen te vinden
- Onderzoekers tonen aan dat geïntroduceerde tardigrade-eiwitten de stofwisseling in menselijke cellen kunnen vertragen
- Hoe orchideeën werken
- Het opzetten van een genoombrede kaart van bacteriële genen die cruciaal zijn voor de kolonisatie van planten door nuttige microben
- Stamcelvaccins: de nieuwe grens in kanker-therapie?
- T. rex niet zo slim als eerder werd beweerd, vinden wetenschappers
- Hoe vloeistofdynamica en transport de structuur van onze longen vormden tijdens de evolutie
- Wetenschappers ontdekken hoe eiwitten kristallen vormen die de schaal van een microbe bekleden
- Een sleutel vinden om geblokkeerde differentiatie in microRNA-deficiënte embryonale stamcellen te ontgrendelen
- Extreme biomimetica - de zoektocht naar natuurlijke bronnen van materiaaltechnische inspiratie
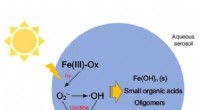
- Effecten van Fenton-achtige reacties van ijzeroxalaat op atmosferische oxidatieprocessen en stralingsforcering
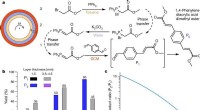
- Een nieuwe manier om opeenvolgingen van chemische reacties te automatiseren
- Celdoodblokker voorkomt dat gezonde cellen afsterven

- Model voorspelt de neiging van polymere voedselverpakkingen om aromamoleculen uit hun inhoud te absorberen

 Toekomstige informatietechnologieën:topologische materialen voor ultrasnelle spintronica
Toekomstige informatietechnologieën:topologische materialen voor ultrasnelle spintronica Stabiele perovskiet-LED's een stap dichterbij
Stabiele perovskiet-LED's een stap dichterbij Onderzoekers onderzoeken hoe bossen veranderen als reactie op de opwarming van de aarde
Onderzoekers onderzoeken hoe bossen veranderen als reactie op de opwarming van de aarde Het oude Mars was warm met af en toe regen, koud worden
Het oude Mars was warm met af en toe regen, koud worden Een studie weerlegt de overeenkomsten tussen de tanden van Denisovans en moderne Aziaten
Een studie weerlegt de overeenkomsten tussen de tanden van Denisovans en moderne Aziaten Extreme hittegolven zetten meren en rivieren deze zomer in heet water
Extreme hittegolven zetten meren en rivieren deze zomer in heet water Hoe exploderende mangaten werken
Hoe exploderende mangaten werken  Een oerervaring:Amerikanen verblind door zonsverduistering (Update)
Een oerervaring:Amerikanen verblind door zonsverduistering (Update)
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

