
Wetenschap
Hoe een watermolecuul te splitsen
Elektrolyse is het proces waarbij elektriciteit wordt gebruikt om water te splitsen in waterstof- en zuurstofgas. Dit proces is de meest gebruikte methode voor het verdelen van water, en het is relatief eenvoudig. Leid eenvoudigweg een elektrische stroom door water en de waterstof- en zuurstofatomen worden gescheiden. De waterstofatomen zullen zich verzamelen bij de negatieve elektrode, en de zuurstofatomen zullen zich verzamelen bij de positieve elektrode.
2.) Zonne-energie
Zonne-energie kan ook worden gebruikt om water te splitsen. Dit proces wordt fotolyse genoemd en vindt plaats wanneer zonlicht watermoleculen raakt en elektronen van de waterstofatomen afstoot. De waterstofatomen zullen zich dan verzamelen bij de negatieve elektrode, en de zuurstofatomen zullen zich verzamelen bij de positieve elektrode.
3.) Hoge temperatuur
Water kan ook worden gesplitst door gebruik te maken van hoge temperaturen. Dit proces wordt thermochemische watersplitsing genoemd en vindt plaats wanneer watermoleculen worden verwarmd tot zeer hoge temperaturen (meer dan 2000 graden Celsius). De hoge temperaturen zorgen ervoor dat de watermoleculen uiteenvallen in waterstof- en zuurstofgas.
4.) Fotokatalyse
Fotokatalyse is een proces waarbij lichtenergie wordt gebruikt om water te splitsen. Dit proces vindt plaats wanneer een halfgeleidermateriaal wordt blootgesteld aan licht. De lichtenergie exciteert de elektronen in de halfgeleider, en de elektronen worden vervolgens gebruikt om watermoleculen te splitsen in waterstof- en zuurstofgas.
5.) Biologische processen
Bepaalde soorten bacteriën kunnen water splitsen met behulp van een proces dat bekend staat als bacteriële fotosynthese. Dit proces vindt plaats wanneer bacteriën zonlicht gebruiken om kooldioxide en water om te zetten in organisch materiaal. De waterstofatomen in het water komen vrij als waterstofgas.
6.) Superkritisch water
Water kan worden gesplitst in waterstof en zuurstof door het te verwarmen tot een superkritische toestand, die boven de kritische temperatuur (374 °C) en kritische druk (218 atm) van water ligt. In deze toestand verliest water zijn vloeibare structuur en wordt het een dichte, gasachtige vloeistof die verschillende stoffen kan oplossen. Wanneer superkritisch water wordt blootgesteld aan hoge drukken en temperaturen, verzwakken en breken de bindingen tussen waterstof- en zuurstofatomen, wat leidt tot de vorming van waterstof- en zuurstofgassen.
Dit zijn slechts enkele van de methoden die kunnen worden gebruikt om water te splitsen. Afhankelijk van de specifieke toepassing kan de ene methode geschikter zijn dan de andere.
 Wetenschappers ontwikkelen duurzame manier om chitine uit garnalenschelpen te extraheren door het te vergisten met fruitafval
Wetenschappers ontwikkelen duurzame manier om chitine uit garnalenschelpen te extraheren door het te vergisten met fruitafval Periodiek systeem ontdekt in St. Andrews erkend als oudste ter wereld
Periodiek systeem ontdekt in St. Andrews erkend als oudste ter wereld Blauw licht voor RNA-controle
Blauw licht voor RNA-controle Close-ups van korrelgrenzen onthullen hoe zwavelonzuiverheden nikkel broos maken
Close-ups van korrelgrenzen onthullen hoe zwavelonzuiverheden nikkel broos maken Revolutionaire ontdekking van geneesmiddelen met RNA in de schijnwerpers
Revolutionaire ontdekking van geneesmiddelen met RNA in de schijnwerpers
Hoofdlijnen
- Hoe kleine chromosomen met grote concurreren om de aandacht van een cel
- Interessante feiten over plantencellen
- Waarom zijn botten belangrijk voor het lichaam?
- Lijst met waterverontreinigende stoffen
- Onderwaterzweefvliegtuigen kunnen de manier veranderen waarop wetenschappers vissen volgen
- Onderzoeken hoe totipotentie-pionierfactor Nr5a2 het genoom in zygoten activeert
- Grote dalingen gemeld in de Zuid-Koreaanse handel in grote katachtigen
- Nieuwe technologie verlicht microben die niet in een laboratorium kunnen worden gekweekt
- Waarom sommige grassen een efficiëntere fotosynthese ontwikkelden en andere niet
- Uitzettend polymeer maakt zelfvouwende afdrukbare structuren mogelijk zonder verwarming of onderdompeling in water

- Structuur van vetverwerkend enzym bepaald
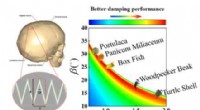
- De relatie tussen delicate hechtdraadstructuur en dempende prestaties van biomaterialen
- Onderzoekers onderzoeken het gebruik van nieuwe materialen om efficiëntere zonnecellen te maken

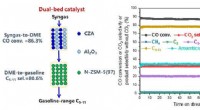
- Dubbelbedkatalysator maakt een hoge omzetting van syngas in vloeibare koolwaterstoffen in het benzinebereik mogelijk
 Tassen of bakken? Als het om recycling gaat, is het antwoord ingewikkeld
Tassen of bakken? Als het om recycling gaat, is het antwoord ingewikkeld De aard van glasvormende vloeistoffen opgehelderd
De aard van glasvormende vloeistoffen opgehelderd Onderzoekers creëren nieuwe routekaart voor het berekenen van de maatschappelijke kosten van koolstof
Onderzoekers creëren nieuwe routekaart voor het berekenen van de maatschappelijke kosten van koolstof Experimenten laten zien hoe memristors werken
Experimenten laten zien hoe memristors werken Onderzoekers ontdekken hoe kleine plastics door het milieu glippen
Onderzoekers ontdekken hoe kleine plastics door het milieu glippen  Wetenschappers produceren een magnetisch nanokristal met veel potentiële toepassingen
Wetenschappers produceren een magnetisch nanokristal met veel potentiële toepassingen Hoe giftig is het wateroppervlak van de Indian River-lagune in Florida?
Hoe giftig is het wateroppervlak van de Indian River-lagune in Florida? Verkoudheidsvirussen onthullen een van hun sterke punten
Verkoudheidsvirussen onthullen een van hun sterke punten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

