Wetenschap
Een nieuwe aanpak kan de antibioticaresistentie tegen Mycobacterium abscessus aanpakken
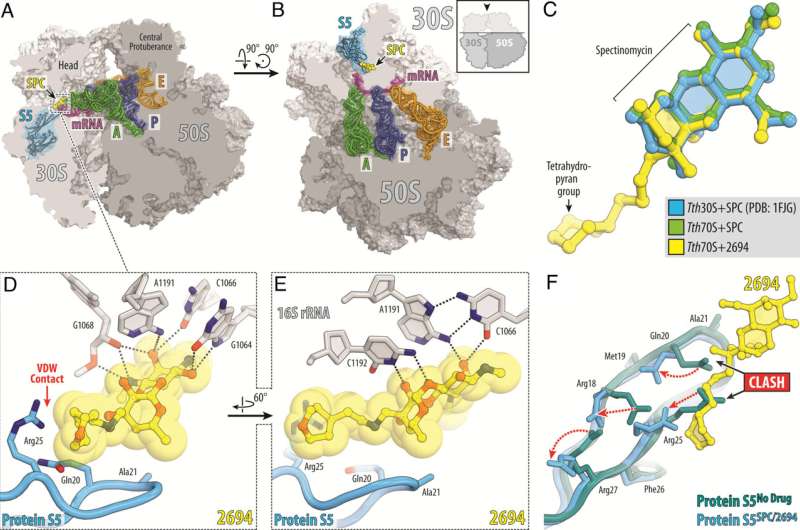
Wetenschappers van het St. Jude Children's Research Hospital pakken de antibioticaresistentie van Mycobacterium abscessus (Mab) aan. Deze van nature antibioticaresistente ziekteverwekker komt steeds vaker voor, wat de dringende behoefte aan nieuwe therapieën benadrukt. Om dit aan te pakken, ontwierpen de wetenschappers nieuwe versies van het medicijn spectinomycine die de efflux overwinnen, het belangrijkste mechanisme dat resistentie aandrijft. Het werk is gepubliceerd in Proceedings of the National Academy of Science .
Mab-infecties worden steeds vaker aangetroffen in gezondheidszorgomgevingen. Dergelijke infecties kunnen gevaarlijk zijn voor patiënten met een aangetaste longfunctie, zoals bij cystische fibrose, of bij patiënten die immunologisch aangetast zijn, zoals bij kinderkanker. Deze infecties worden behandeld met lange antibioticakuren en kunnen tot slechte resultaten leiden.
De opkomst van Mab en andere soortgelijke ziekteverwekkers vormt een groeiende en zeer zorgwekkende bedreiging voor de volksgezondheid, omdat er weinig effectieve therapeutische opties zijn en een beperkte pijplijn voor de ontwikkeling van geneesmiddelen.
"Wij scheikundigen zijn in een race tegen de ziekteverwekkers. We maken sterkere antibiotica en de ziekteverwekkers worden resistenter", zegt corresponderende auteur Richard Lee, Ph.D., St. Jude Department of Chemical Biology and Therapeutics.
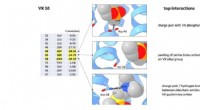
Wetenschappers van St. Jude hebben het natuurlijk voorkomende antibioticum spectinomycine aangepast om analogen te creëren, vergelijkbare maar structureel verschillende N-ethyleen-gekoppelde aminomethylspectinomycinen (eAmSPC's). Deze synthetisch gemaakte eAmSPC's zijn tot 64 keer krachtiger tegen Mab dan standaard spectinomycine.
"Door het molecuul opnieuw te ontwerpen door middel van op structuur gebaseerd medicijnontwerp, hebben wij en onze medewerkers het antibioticum aangepast om de activiteit ervan te vergroten," voegde Lee eraan toe.
Efflux overwinnen om een effectiever antibioticum te maken
Door hun werk hebben de wetenschappers het werkingsmechanisme ontrafeld waardoor eAmSPC's effectiever zijn:ze omzeilen efflux. Efflux is het proces dat cellen gebruiken om van een medicijn af te komen (stel je voor dat je water uit een ondergelopen kelder pompt) en is een belangrijk mechanisme waardoor cellen resistent worden tegen therapie.
De N-ethyleen-koppelingsstructuur van de eAmSPC's speelt een cruciale rol in de manier waarop de verbindingen efflux vermijden, wat suggereert dat langere koppelingen de manier wijzigen waarop de verbinding uit de cel wordt gepompt. Dit verschuift uiteindelijk de balans naar hogere concentraties eAmSPC in de cel en verbetert zo de antimicrobiële werkzaamheid.
"In de afgelopen twintig jaar hebben we een enorme toename gezien in het aantal infecties veroorzaakt door niet-tuberculeuze mycobacteriën zoals Mab", zegt co-eerste auteur Gregory Phelps, PharmD, St. Jude Graduate School of Biomedical Sciences. "We hadden een plek om te beginnen met dit natuurlijk voorkomende antibioticum, dat we door modificatie veel effectiever hebben gemaakt tegen deze klinisch relevante ziekteverwekker."
De onderzoekers ontdekten ook dat eAmSPC's goed werken met verschillende klassen antibiotica die worden gebruikt om Mab te behandelen en hun activiteit tegen andere mycobacteriële stammen behouden. Dit werk toont aan dat eAmSPC's verder bestudeerd en ontwikkeld moeten worden, omdat zodra de kwesties van verdraagbaarheid en veiligheid zijn aangepakt, deze verbindingen de volgende generatie therapieën zouden kunnen worden.
"Het is om verschillende economische redenen een uitdaging om farmaceutische bedrijven aan te trekken om nieuwe antibiotica te ontwikkelen", zegt Phelps. "Als we de medicijnpijplijn tegen deze moeilijk te behandelen bacterie kunnen stimuleren, kunnen we potentieel een verschil maken voor patiënten zoals die we hier bij St. Jude hebben, die steeds vaker worden geconfronteerd met beperkte of geen therapeutische opties."
Meer informatie: Gregory A. Phelps et al, Ontwikkeling van aminomethylspectinomycines van de tweede generatie die de natuurlijke efflux in Mycobacterium abscessus overwinnen, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2314101120
Journaalinformatie: Proceedings van de Nationale Academie van Wetenschappen
Aangeboden door St. Jude Children's Research Hospital
 Synthetische routes veranderen planten in biofabrieken voor nieuwe moleculen
Synthetische routes veranderen planten in biofabrieken voor nieuwe moleculen Slimme scheikunde verlost medicijnen tegen kanker van ernstige bijwerkingen
Slimme scheikunde verlost medicijnen tegen kanker van ernstige bijwerkingen Hoe werken warmtesensoren?
Hoe werken warmtesensoren?  De in de aarde overvloedige ijzerkatalyse maakt toegang tot waardevolle gedialkyleerde verbindingen mogelijk
De in de aarde overvloedige ijzerkatalyse maakt toegang tot waardevolle gedialkyleerde verbindingen mogelijk  Team ontdekt een fundamenteel nieuwe manier om straling te detecteren met goedkope keramiek
Team ontdekt een fundamenteel nieuwe manier om straling te detecteren met goedkope keramiek
Hoofdlijnen
- Etniciteit versus ras versus nationaliteit:een uitlegger
- Waarom wordt natrium gebruikt bij DNA-extractie?
- Onderzoekers delen een routekaart ter bevordering van duurzame visserij
- Wetenschappers onthullen de prachtige eenvoud die ten grondslag ligt aan vertakkingspatronen in weefsel
- Antibioticavervuiling verstoort het darmmicrobioom en blokkeert het geheugen van waterslakken, zo blijkt uit onderzoek
- In populaties van microben, bio-ingenieurs vinden een balans tussen tegengestelde genomische krachten
- 3 soorten mutaties die kunnen optreden in het DNA Molecuul
- Nieuwe studie geeft aan hoe bevruchting veranderingen teweegbrengt in duizenden eiwitten in kikkereieren
- Oud DNA van een uitgestorven inheemse eend onthult hoe ver vogels vlogen om Nieuw-Zeeland thuis te brengen
 Wereldwijde methaanemissies door landbouw groter dan gerapporteerd, volgens nieuwe schattingen
Wereldwijde methaanemissies door landbouw groter dan gerapporteerd, volgens nieuwe schattingen Gadgets:Draadloos is tegenwoordig de hete oordopje - met een goede reden
Gadgets:Draadloos is tegenwoordig de hete oordopje - met een goede reden Nieuw begrip van Keniaanse paleo-omgevingen opent venster op menselijke evolutie in het gebied
Nieuw begrip van Keniaanse paleo-omgevingen opent venster op menselijke evolutie in het gebied Wetenschappers proberen Californische bossen vuurbestendiger te maken
Wetenschappers proberen Californische bossen vuurbestendiger te maken Vorm vinden door te vouwen
Vorm vinden door te vouwen Hoe de baan Slope
Hoe de baan Slope Nieuwe microscooptechniek onthult details van druppelkiemvorming
Nieuwe microscooptechniek onthult details van druppelkiemvorming Reddit opent kantoor in Chicago als onderdeel van reclame-push
Reddit opent kantoor in Chicago als onderdeel van reclame-push
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com