
Wetenschap
Solar-to-fuel-systeem recycleert CO2 om ethanol en ethyleen te maken
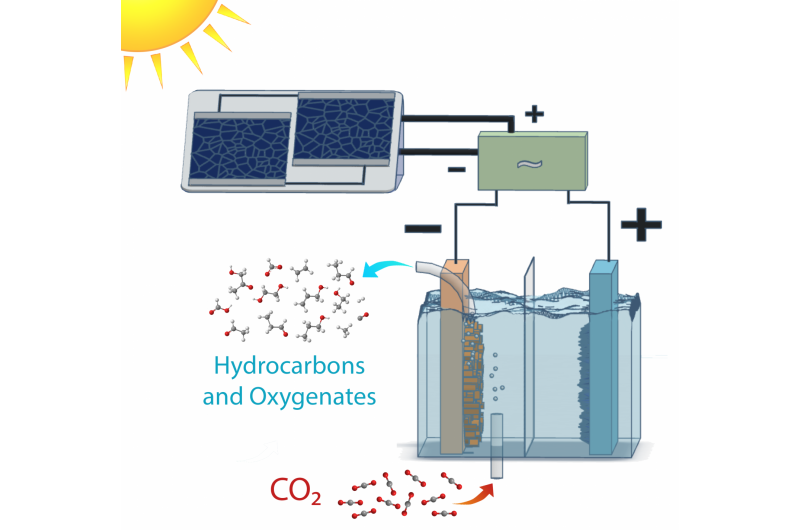
Schema van een op zonne-energie werkende elektrolysecel die kooldioxide omzet in koolwaterstof- en oxygenaatproducten met een efficiëntie die veel hoger is dan die van natuurlijke fotosynthese. Dankzij de elektronica die het vermogen aanpast, kan het systeem werken onder een reeks van zoncondities. Krediet:Clarissa Towle/Berkeley Lab
Wetenschappers van het Lawrence Berkeley National Laboratory (Berkeley Lab) van het Department of Energy hebben de kracht van fotosynthese gebruikt om koolstofdioxide om te zetten in brandstoffen en alcoholen met een efficiëntie die veel groter is dan die van planten. De prestatie markeert een belangrijke mijlpaal in het streven naar duurzame brandstofbronnen.
Veel systemen hebben met succes kooldioxide gereduceerd tot chemische en brandstofprecursoren, zoals koolmonoxide of een mengsel van koolmonoxide en waterstof, bekend als syngas. Dit nieuwe werk, beschreven in een studie gepubliceerd in het tijdschrift Energie- en milieuwetenschappen , is de eerste die met succes de aanpak demonstreert om van kooldioxide rechtstreeks naar doelproducten te gaan, namelijk ethanol en ethyleen, bij energieomzettingsrendementen die wedijveren met natuurlijke tegenhangers.
De onderzoekers deden dit door elk onderdeel van een fotovoltaïsch-elektrochemisch systeem te optimaliseren om spanningsverlies te verminderen, en het creëren van nieuwe materialen wanneer bestaande niet volstonden.
"Dit is een spannende ontwikkeling, " zei hoofdonderzoeker Joel Ager, een Berkeley Lab-wetenschapper met gezamenlijke aanstellingen in de divisies Materials Sciences en Chemical Sciences. "Als stijgende atmosferische CO2-niveaus het klimaat op aarde veranderen, de noodzaak om duurzame energiebronnen te ontwikkelen is steeds urgenter geworden. Ons werk hier laat zien dat we een plausibele weg hebben om brandstoffen rechtstreeks uit zonlicht te maken."
Dat pad van zon naar brandstof is een van de belangrijkste doelen van het Joint Centre for Artificial Photosynthesis (JCAP), een DOE Energy Innovation Hub opgericht in 2010 om onderzoek naar zonnebrandstof te bevorderen. Het onderzoek werd uitgevoerd op de Berkeley Lab-campus van JCAP.
De initiële focus van het JCAP-onderzoek was het aanpakken van de efficiënte splitsing van water in het fotosyntheseproces. Nadat we die taak grotendeels hadden bereikt met behulp van verschillende soorten apparaten, JCAP-wetenschappers die door zonne-energie aangestuurde kooldioxidereductie deden, begonnen hun zinnen te zetten op het bereiken van efficiënties die vergelijkbaar zijn met die aangetoond voor watersplitsing, door velen beschouwd als de volgende grote uitdaging in kunstmatige fotosynthese.
Een andere onderzoeksgroep van Berkeley Lab pakt deze uitdaging aan door zich te concentreren op een specifieke component in een fotovoltaïsch-elektrochemisch systeem. In een vandaag gepubliceerde studie ze beschrijven een nieuwe katalysator die de conversie van koolstofdioxide naar multikoolstof kan bereiken met behulp van record-lage inputs van energie.
Niet alleen voor de middag
Voor deze JCAP-studie onderzoekers ontwikkelden een compleet systeem om op verschillende tijdstippen van de dag te werken, niet alleen bij een lichtenergieniveau van 1-zon verlichting, wat gelijk is aan de piek van helderheid op het middaguur op een zonnige dag. Ze varieerden de helderheid van de lichtbron om aan te tonen dat het systeem zelfs bij weinig licht efficiënt bleef.
Toen de onderzoekers de elektroden koppelden aan silicium fotovoltaïsche cellen, ze bereikten een zonneconversie-efficiëntie van 3 tot 4 procent voor 0,35 tot 1-zonverlichting. De configuratie wijzigen in een high-performance, tandemzonnecel die in tandem was verbonden, leverde een conversie-efficiëntie op naar koolwaterstoffen en oxygenaten van meer dan 5 procent bij 1-zonverlichting.

Links is een oppervlakteaanzicht van een bimetaal koper-zilver nanokoraal kathode genomen van een scanning elektronenmicroscoop. Rechts is een energie-dispersief röntgenbeeld van de kathode met het koper (in roze/rood) en zilver (in groen) gemarkeerd. Krediet:Gurudayal/Berkeley Lab
"We deden een dansje in het lab toen we 5 procent bereikten, " zei Ager, die ook een aanstelling heeft als adjunct-professor aan de afdeling Materials Science and Engineering van UC Berkeley.
Een van de nieuwe componenten die door de onderzoekers zijn ontwikkeld, is een koper-zilver nanokoraal kathode, die de kooldioxide reduceert tot koolwaterstoffen en oxygenaten, en een iridiumoxide nanobuis anode, die het water oxideert en zuurstof creëert.
"Het leuke van het nanokoraal is dat, zoals planten, het kan de doelproducten maken over een breed scala van omstandigheden, en het is zeer stabiel, ' zei Ager.
De onderzoekers karakteriseerden de materialen in het National Center for Electron Microscopy van de Molecular Foundry, een DOE Office of Science User Facility bij Berkeley Lab. De resultaten hielpen hen te begrijpen hoe de metalen in de bimetaalkathode functioneerden. specifiek, ze leerden dat zilver helpt bij de reductie van kooldioxide tot koolmonoxide, terwijl het koper van daaruit oppikt om koolmonoxide verder te reduceren tot koolwaterstoffen en alcoholen.
Beter zoeken, energiebesparende scheidingen
Omdat koolstofdioxide een hardnekkig stabiel molecuul is, het opbreken ervan brengt doorgaans een aanzienlijke hoeveelheid energie met zich mee.
"Het reduceren van CO2 tot een koolwaterstof eindproduct zoals ethanol of ethyleen kan tot 5 volt duren, begin tot einde, " zei hoofdauteur Gurudayal, postdoctoraal onderzoeker bij Berkeley Lab. "Ons systeem heeft dat gehalveerd met behoud van de selectiviteit van producten."
Opmerkelijk, de elektroden werkten goed in water, een neutrale pH-omgeving.
"Onderzoeksgroepen die aan anoden werken, doen dit meestal onder alkalische omstandigheden, omdat anoden doorgaans een omgeving met een hoge pH vereisen, wat niet ideaal is voor de oplosbaarheid van CO2, "zei Gurudayal. "Het is erg moeilijk om een anode te vinden die in neutrale omstandigheden werkt."
De onderzoekers hebben de anode aangepast door de iridiumoxide-nanobuisjes op een zinkoxide-oppervlak te laten groeien om een meer uniform oppervlak te creëren om chemische reacties beter te ondersteunen.
"Door elke stap zo zorgvuldig te doorlopen, deze onderzoekers toonden een prestatie- en efficiëntieniveau dat mensen op dit moment niet voor mogelijk hielden, " zei Berkeley Lab-chemicus Frances Houle, JCAP adjunct-directeur voor Wetenschap en Onderzoek Integratie, die geen deel uitmaakte van het onderzoek. "Dit is een grote stap voorwaarts in het ontwerpen van apparaten voor efficiënte CO2-reductie en het testen van nieuwe materialen, en het biedt een duidelijk kader voor de toekomstige vooruitgang van volledig geïntegreerde door zonne-energie aangedreven apparaten voor CO2-reductie."
 Hogere koolstofdioxidegehaltes kunnen ons denken in de war brengen
Hogere koolstofdioxidegehaltes kunnen ons denken in de war brengen De vorming van steenkool veranderde onze planeet bijna in een sneeuwbal
De vorming van steenkool veranderde onze planeet bijna in een sneeuwbal Kenmerken van geofysische turbulentie op submesoschaal
Kenmerken van geofysische turbulentie op submesoschaal Onderzoekers onthullen veranderingen in het water van het Canadese noordpoolgebied
Onderzoekers onthullen veranderingen in het water van het Canadese noordpoolgebied in Alaska, min 59 eist zijn tol van auto's, pijpen, gemoedstoestand
in Alaska, min 59 eist zijn tol van auto's, pijpen, gemoedstoestand
Hoofdlijnen
- Mitochondria-afweer van dieren ontdekt in planten
- Wat zijn de purine basen van DNA?
- Wat zijn enkele goede DNA-wetenschapsprojecten?
- UFO-psychologie
- Afrika stroperij nu een oorlog, taskforce waarschuwt
- Wat zijn de kenmerken die alle bacteriën gemeen hebben?
- Onderwaterkwekerijen helpen de mediterrane visbestanden nieuw leven in te blazen
- Bootverkeer bedreigt het voortbestaan van de Bocas Del Toro-dolfijnen in Panama
- Signaaltransductie: definitie, functie, voorbeelden
- De weg naar een waterstofeconomie etsen met behulp van plasmajets

- In een eerste, kleine diamanten aambeelden veroorzaken chemische reacties door erin te knijpen

- Nieuw materiaal waarvan is aangetoond dat het water efficiënter ontzilt

- Superbug-strijd:bacteriestructuur kan de sleutel zijn tot nieuwe antibiotica
- Blauw-emitterende diode demonstreert beperkingen en belofte van perovskiet-halfgeleiders
 End-to-end leren van het genereren van co-spraakgebaren voor humanoïde robots
End-to-end leren van het genereren van co-spraakgebaren voor humanoïde robots Weergave van rijgedrag als statistisch model
Weergave van rijgedrag als statistisch model Stabiliteit, veiligheid in gevaar voor de helft van de kinderen in gedeelde of dubbele huishoudens, onderzoek vindt
Stabiliteit, veiligheid in gevaar voor de helft van de kinderen in gedeelde of dubbele huishoudens, onderzoek vindt Verschil tussen transcriptie en DNA-replicatie
Verschil tussen transcriptie en DNA-replicatie  Van bosbranden tot terrorisme:hoe gemeenschappen veerkrachtig worden
Van bosbranden tot terrorisme:hoe gemeenschappen veerkrachtig worden Nanobolletjes gemaakt van aromatische aminozuren:de meest rigide organische nanostructuren tot nu toe
Nanobolletjes gemaakt van aromatische aminozuren:de meest rigide organische nanostructuren tot nu toe Genderongelijkheid in de wetenschap corrigeert zichzelf niet:het is tijd voor actie
Genderongelijkheid in de wetenschap corrigeert zichzelf niet:het is tijd voor actie Facebook sloot deals over data en verbrandde rivalen, zeggen Britse wetgevers
Facebook sloot deals over data en verbrandde rivalen, zeggen Britse wetgevers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

