
Wetenschap
Cryo-elektronenmicroscopische structuur van een proton-geactiveerd chloridekanaal genaamd TMEM206
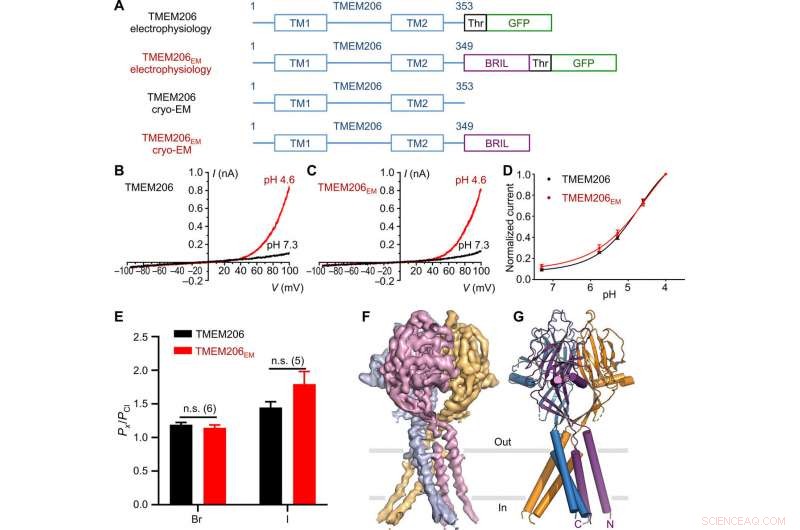
Functie en structuur van kogelvis TMEM206. (A) Schematische voorstelling van kanaalconstructies die worden gebruikt voor elektrofysiologie en cryo-EM-experimenten met één deeltje. "Thr" stelt een trombinesplitsingsplaats voor. (B en C) Representatieve hele cel huidige sporen geactiveerd door extracellulaire pH 4,6 voor kogelvissen TMEM206 (B) en TMEM206EM (C). Kanaalconstructen werden tot expressie gebracht in TMEM206 knock-out menselijke embryonale nier (HEK) 293T-cellen. (D) Genormaliseerde huidige-naar-pH-relaties van kogelvissen TMEM206 (n =6 tot 9 cellen per gegevenspunt) en TMEM206EM (n =5 tot 6 cellen per gegevenspunt). Alle stromen werden geregistreerd bij kamertemperatuur en genormaliseerd tot pH 4,0 stromen bij +100 mV. (E) Anionselectiviteit voor kogelvissen TMEM206 en TMEM206EM. Gegevens worden weergegeven als gemiddelden ± SEM (n.s., niet significant; t-toets van de student). (F) Cryo-EM-dichtheid van kogelvissen TMEM206EM met een contour van 7,0 en gekleurd door individuele subeenheden. (G) Trimere structuur van kogelvis TMEM206EM. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.abe5983
Het transmembraaneiwit 206, afgekort als TMEM206, is een evolutionair geconserveerd chloridekanaal dat ten grondslag ligt aan het alomtegenwoordige, proton-geactiveerd, uiterlijk corrigerende anionstromen. In een nieuw rapport dat nu is gepubliceerd op wetenschappelijke vooruitgang , Zengqin Deng en een multidisciplinair onderzoeksteam aan de Washington University School of Medicine, in Saint-Louis, US beschreef de cryo-elektronenmicroscopie (cryo-EM) structuur van de kogelvis TMEM206. De structuur vormde een trimeer kanaal met twee transmembraansegmenten en een groot extracellulair domein. Volgens de resultaten, Deng et al. liet zien hoe een ruime vestibule in het extracellulaire gebied zijdelings toegankelijk was vanaf drie zijportalen, waar de centrale porie meerdere constructies bevatte. Bijvoorbeeld, een geconserveerd lysineresidu dichtbij het cytoplasmatische gebied van de binnenste helix, vermoedelijk vormde het chloride-ionselectiviteitsfilter. De kernstructuur en samenstelling leken op die van natriumkanalen die niet verwant zijn in aminozuursequentie, en geleiden daarom kationen in plaats van anionen. Samen met elektrofysiologie leverden ze inzichten op over ionengeleiding en gating voor een nieuwe klasse van chloridekanalen die architectonisch verschillend zijn van eerder beschreven chloridekanaalfamilies.
Chloride-ionkanalen
Chloride-ionen zijn overvloedige anionen bij dieren, en ze bewegen door celmembranen via chloridekanalen en transporters voor een verscheidenheid aan cellulaire functies, inclusief celvolumeregulatie, intracellulaire verzuring en prikkelbaarheid controle in spieren. De ionen worden op grote schaal waargenomen in zoogdiercellen, hoewel de moleculaire componenten achter de chloridestromen tot nu toe ongrijpbaar zijn gebleven. Twee onafhankelijke onderzoeken die genoombrede RNA-interferentiescreening gebruikten, hadden TMEM206 geïdentificeerd als het onderliggende anionkanaal. De TMEM206 is evolutionair geconserveerd in gewervelde dieren. Chloridekanalen zijn divers in zowel aminozuursequentie als driedimensionale architectuur. In dit werk, Deng et al. presenteerde een cryo-elektronenmicroscopie (cryo-EM) structuur van kogelvis TMEM206 om een trimere kanaalarchitectuur te onthullen die verschilt van de eerder bekende. De wetenschappers combineerden elektrofysiologie met dit werk om de eerste structurele en functionele beschrijving te geven van een evolutionair geconserveerd en breed uitgedrukt chloridekanaal om een moleculair raamwerk te creëren en chloridegeleiding en kanaalgating te begrijpen.
Subeenheidstructuur en kanaalassemblage. (A) Structuur van een enkele subeenheid, met het transmembraandomein (rood), binnenste β-domein (blauw), buitenste β-domein (oranje), en HTH (groen). Secundaire structuurelementen zijn aangegeven. (B) Trimere kanaal montage. Twee van de subeenheden worden weergegeven in oppervlakteweergave. (C) orthogonale weergave zoals in (B), van de extracellulaire kant. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.abe5983 
De onderzoekers gebruikten groen fluorescerende eiwit-gelabelde constructies om TMEM206-kandidaten te identificeren en selecteerden kogelvissen TMEM206 vanwege hun 50 procent gedeelde sequentie-identiteit met het menselijke chloridekanaal. Deng et al. vervolgens het wildtype kogelvis TMEM206-eiwit van volledige lengte gezuiverd en onderworpen aan cryo-EM-analyse met één deeltje. Met behulp van 3D-reconstructiekaarten, ze onthulden een trimere kanaalarchitectuur met transmembraan- en extramembraandomeinen. De TMEM206 vormde een symmetrisch trimeer, waarbij elke subeenheid een transmembraandomein (TMD) bevatte met twee membraanoverspannende helices genaamd TM1 en TM2 en een groot extracellulair domein (ECD) verrijkt met β-domeinen met extra motieven die verder zijn georganiseerd in de bovenste en onderste lagen. Aanvullend, uitgebreide zijketencontacten waren betrokken via van der Waals-interacties in de binnenste en buitenste domeinen. Het trimere kanaalsamenstel introduceerde drie laterale openingen of zijportalen in het midden van het extracellulaire gebied om waarschijnlijk de doorgang van ionen en water te vergemakkelijken. De langwerpige zijportalen strekten zich uit tot de ECD-TMD-kruising om de nauwe verpakkingsinteracties te hervatten. Om technische moeilijkheden bij het bepalen van de structuur van het eiwit te overwinnen, Deng et al. fuseerde het C-uiteinde van door bot beperkt interferon-geïnduceerd transmembraanachtig eiwit (afgekort BRIL); een eiwit met vier helixen dat op grote schaal wordt gebruikt als chaperonne voor kristallisatie om de membraanstabiliteit te verbeteren en kristalvorming te bevorderen.
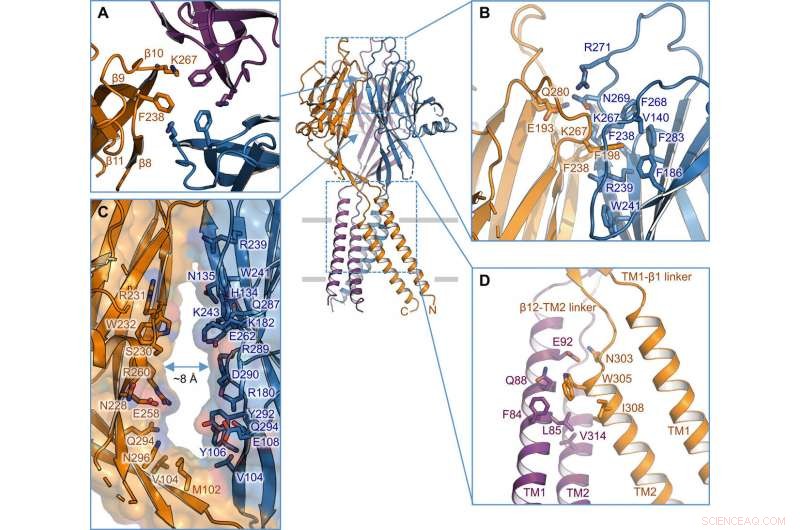
Intersubeenheid-interface. (A) Trimere interface aan de top van de ECD. Zijketens van K267 en F238 zijn gemarkeerd. (B) zijaanzicht van de intersubunit-interface op de bovenste laag van de ECD. Residuen die betrokken zijn bij de interface worden getoond in stokweergave. (C) zijportaal in het midden van de ECD tussen twee aangrenzende subeenheden. Oppervlak en resten langs de muur worden geïllustreerd. (D) TM1-TM2 intersubeenheid-interface. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.abe5983
Ionenpermeatieroute en mutagenesestudies
Met behulp van poriestraalberekeningen, Deng et al. toonde aan hoe de centrale ionengeleidingsporie meerdere vernauwingen bevatte om ionenpassage te voorkomen. De structuur vertegenwoordigde niet-geleidende conformatie vanwege de hoge pH-bufferomstandigheden (pH 8,0) die werden gebruikt om de cryo-EM-structuur te bepalen. De omvangrijke en langwerpige centrale vestibule was lateraal toegankelijk vanwege het ontbreken van eiwit-eiwitcontacten in het extracellulaire domein. Het smalle punt van het eiwitkanaal interfereerde niet met ionengeleiding en kon worden gehandhaafd tijdens de kanaalpoortcyclus terwijl ionen door de drie zijportalen gingen. De licht positieve elektrostatische potentiaal van de binnenwanden van de centrale vestibule en zijingangen vergemakkelijkte ook de aantrekking van chloride-ionen. Op de extracellulaire domein-transmembraandomein (ECD-TMD) kruising, drie strengen verbonden met de buitenste helices en naar binnen bewogen om de binnenste helices samen te voegen om een extracellulaire poort boven de bilipidelaag te genereren. Opeenvolgende constructies op de porie-gerichte posities vormden een hydrofobe poort die ionengeleiding zou kunnen verhinderen.
Om de structurele bevindingen te ondersteunen, Deng et al. voerde mutagenesestudies uit op belangrijke poriënlevende residuen. Wanneer ze de geconserveerde basische residuen vervangen door alanine of zure residuen, de door zuur geactiveerde chloridestromen werden afgeschaft. In tegenstelling tot, arginine-substituties behielden de kanaalfunctie om de vereiste van positieve ladingen in het anion-selectieve filter verder te ondersteunen. Bijvoorbeeld, het I310-domein vormde een kritische component van de transmembraanpoort en een andere structuur die bekend staat als K320 vormde het anionselectiviteitsfilter. Het werk ondersteunde structurele instandhouding tussen de orthologen van de mens en kogelvissen om een fysiologisch relevant model voor chloridekanalen te vertegenwoordigen.
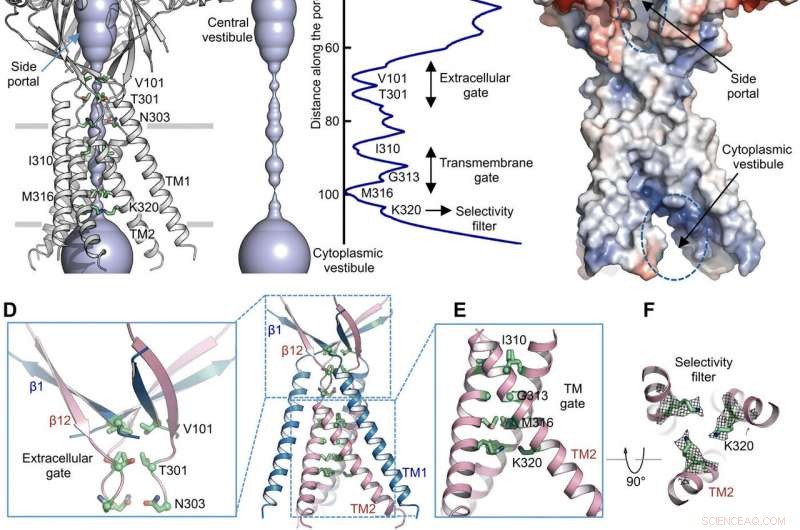
Ionen permeatie route. (A) Structuur van TMEM206EM en de centrale ionengeleidingsporie, weergegeven in oppervlakteweergave. Resten die vernauwingen veroorzaken, worden gemarkeerd en gelabeld. Het zijportaal is aangegeven. (B) centrale ionengeleiding porie en schatting van de straal (rechter paneel). (C) Oppervlakteweergave van het kanaal, gekleurd door de elektrostatische potentiaal van het oppervlak (rood, −5 kT/e; wit, neutrale; blauw, +5 kT/e). Het zijportaal en de cytoplasmatische vestibule zijn aangegeven. (D) Extracellulaire poort op de kruising ECD-TMD. V101, T301, en N303 worden getoond in stokweergave. (E) Transmembraanpoort, gevormd door I310, G313, en M316. (F) Vermeend selectiviteitsfilter gedefinieerd door K320. Ook getoond zijn zijketendichtheden voor K320, voorgevormd op 6,5 . (G en H) Stroomdichtheden met een extracellulaire pH van 7,3 (G) en 4,6 (H) bij +100 mV voor TMEM206-mutanten. De stromen van het hele celmembraan werden geregistreerd door gebruik te maken van een spanningsverhoging van -100 tot +100 mV gedurende 500 ms bij een houdpotentiaal van 0 mV. (I) Verhouding van stroomdichtheid bij pH 4,6 tot pH 7,3. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.abe5983
structurele convergentie
de topologie, structuur en assemblage van TMEM206 vertegenwoordigden die van de epitheliale natriumkanaal (ENaC) / degenerine-superfamilie van ionkanalen, inclusief zuurgevoelige ionenkanalen (ASIC's); ondanks een gebrek aan duidelijke aminozuursequentiehomologie tussen de twee kanalen. De trimere kanalen voor tegengesteld geladen natrium- en chloride-ionen, deelden niettemin een gemeenschappelijke kernstructuur geflankeerd door twee transmembraanhelices. Het team merkte op hoe de extracellulaire poort tussen de centrale vestibule en de transmembraanporie kan worden uitgebreid om ionen door te laten na kanaalactivering. Hoewel epitheliale natriumkanalen kunnen worden geactiveerd door remmende peptiden vrij te geven via proteolyse in het extracellulaire domein, de ASIC's en TMEM206 konden alleen worden geactiveerd door extracellulaire protonen. De geconserveerde structurele kenmerken tussen TMEM en AS1CS suggereerden ook analoge gating conformationele veranderingen voor de twee moleculen.
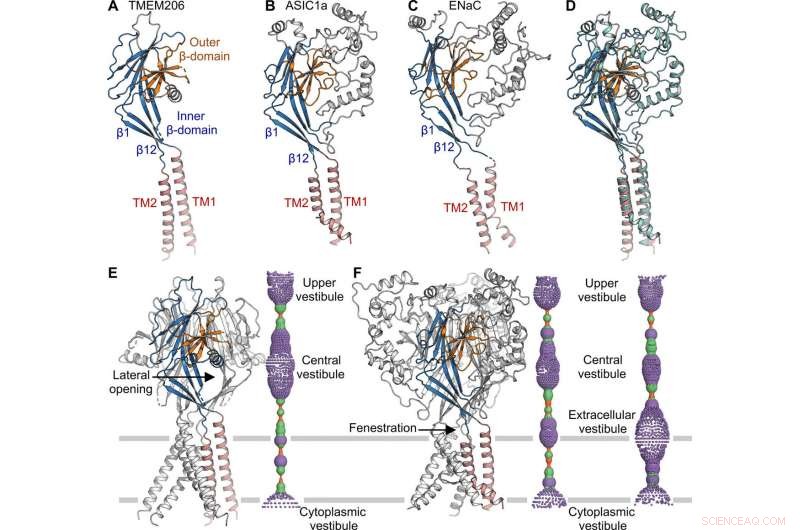
Structurele vergelijking met ASIC en ENaC. (A tot C) Subeenheidstructuren van TMEM206 (A), ASIC1a [Eiwitdatabank (PDB):6AVE] (B), en ENaC (VOB:6BQN) (C). Domeinen hebben dezelfde kleur. (D) Superpositie van TMEM206, gekleurd zoals in (A), en ASIC1a gekleurd in cyaan. (E) Trimere TMEM206-kanaal en de centrale ionengeleidingsporie. De porie wordt geschat met het programma HOLE en weergegeven als gekleurde stippen (poriestraal:rood <1.15
Outlook
Op deze manier, Zengqin Deng en collega's gebruikten single-particle cryo-EM om de structuur te bepalen van integrale membraaneiwitten die doorgaans onbereikbaar zijn met behulp van traditionele röntgenkristallografie. Het is nog steeds een belangrijke technische uitdaging om een bijna-atomaire resolutie te bereiken voor membraaneiwitten van kleine omvang vanwege het lage contrast en de signaal-ruisverhoudingen. Deng et al. verkreeg een 3,5 angstrom resolutiestructuur van een kanaal door een kleine kristallisatiechaperone BRIL te fuseren om de stabiliteit van de anders suboptimale membraaneiwitten te verbeteren om kristalverpakking te bevorderen. Op basis van de geconserveerde kernstructuur, de kanalen waren selectief voor kationen of anionen en ondervonden vergelijkbare conformationele veranderingen in de poort. Het werk bracht een nieuwe klasse van chloridekanalen tot stand om een nieuw raamwerk te vormen voor verder functioneel en mechanisch onderzoek in cel- en structurele biologie.
© 2021 Science X Network
 Nieuw materiaal met magnetisch vormgeheugen
Nieuw materiaal met magnetisch vormgeheugen Chemicus maakt de volgende generatie neurowetenschappelijke tools
Chemicus maakt de volgende generatie neurowetenschappelijke tools Het Marangoni-effect kan worden gebruikt om zoet water uit de zee te halen
Het Marangoni-effect kan worden gebruikt om zoet water uit de zee te halen Nieuw apparaat vereenvoudigt meting van fluorideverontreiniging in water
Nieuw apparaat vereenvoudigt meting van fluorideverontreiniging in water Demonstratie van een piëzo-elektrisch effect van een enkel molecuul
Demonstratie van een piëzo-elektrisch effect van een enkel molecuul
 Engineering van de Mississippi-rivier heeft koolstof uit de atmosfeer gehouden, zegt nieuwe studie
Engineering van de Mississippi-rivier heeft koolstof uit de atmosfeer gehouden, zegt nieuwe studie NASA krijgt een laatste blik op orkaan Gerts regenval
NASA krijgt een laatste blik op orkaan Gerts regenval Hoe kan een veranderend klimaat de menselijke vruchtbaarheid beïnvloeden?
Hoe kan een veranderend klimaat de menselijke vruchtbaarheid beïnvloeden? Filippijnse vulkaan komt weer tot leven, duizenden geëvacueerd
Filippijnse vulkaan komt weer tot leven, duizenden geëvacueerd NASA-infraroodgegevens laten zien dat Cristina sterker wordt
NASA-infraroodgegevens laten zien dat Cristina sterker wordt
Hoofdlijnen
- Wat kan albatrospoep ons vertellen over klimaatverandering?
- Zelfbevruchtende vissen hebben een verrassende hoeveelheid genetische diversiteit
- Maakt Botox je gelukkiger als het je frons wegneemt?
- Vogelherkenning
- Genezing van verbrande poten met vissenhuid
- Wat zijn de functies van longblaasjes in de longen?
- 10, 000 jaar oud DNA bewijst wanneer vissen meren koloniseerden
- Differentiërende RNA & DNA-virussen
- Baby bongo geboren, waarschijnlijk binnenkort in Species Survival Center
- Snelle meting van aërosolvluchtigheid met behulp van een op deep learning gebaseerde draagbare microscoop

- Wetenschappers onthullen structuur van aminozuurtransporter die betrokken is bij kanker

- Onderzoekers ontdekken een nieuwe gunstige functie van een oud eiwit
- Wetenschappers onderzoeken macrocyclische peptiden als nieuwe medicijnsjablonen

- Video:De chemie achter verschillende theesmaken

 Verkiezingen voorspellen met een model van infectieziekten
Verkiezingen voorspellen met een model van infectieziekten Publiek - en onderzoekers - sceptisch over klimaattechniek
Publiek - en onderzoekers - sceptisch over klimaattechniek Deze 9-gangen training leert je Java, Python en meer
Deze 9-gangen training leert je Java, Python en meer  Onderzoekers stellen nieuwe grenzen aan de massa van leptoquarks
Onderzoekers stellen nieuwe grenzen aan de massa van leptoquarks Interactieve Smart Board-breukactiviteiten
Interactieve Smart Board-breukactiviteiten Inzicht in 3D-structuur van enzymen kan biobrandstofkosten verlagen
Inzicht in 3D-structuur van enzymen kan biobrandstofkosten verlagen Sojoez MS-17 levert wetenschappelijke experimenten aan ISS
Sojoez MS-17 levert wetenschappelijke experimenten aan ISS Warmteafvoerende schoenen met grafeenzool
Warmteafvoerende schoenen met grafeenzool
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

