
Wetenschap
Het snuiven van nanodeeltjes geladen met mRNA zou kunnen leiden tot geavanceerde longtherapieën
Onderzoekers van Yale University, New Haven, hebben een op polymeer gebaseerd mRNA-vehikel geoptimaliseerd voor gerichte toediening aan de longen en hebben het potentieel van het platform voor slijmvliesvaccinatie tegen ademhalingspathogenen aangetoond.
In een artikel:"Polymeernanodeeltjes leveren mRNA aan de longen voor mucosale vaccinatie", gepubliceerd in Science Translational Medicine , introduceert het team hun creatie van inhaleerbaar messenger RNA (mRNA) voor therapeutisch gebruik.
Klinisch onderzoek heeft gezocht naar een efficiënte en gerichte manier om mRNA aan de longen af te leveren voor verschillende therapeutische toepassingen, waaronder eiwitvervangingstherapieën, genbewerking en vaccinatie. De belangrijkste uitdagingen waren het handhaven van de mRNA-stabiliteit en het vermijden van immuuninterferentie.
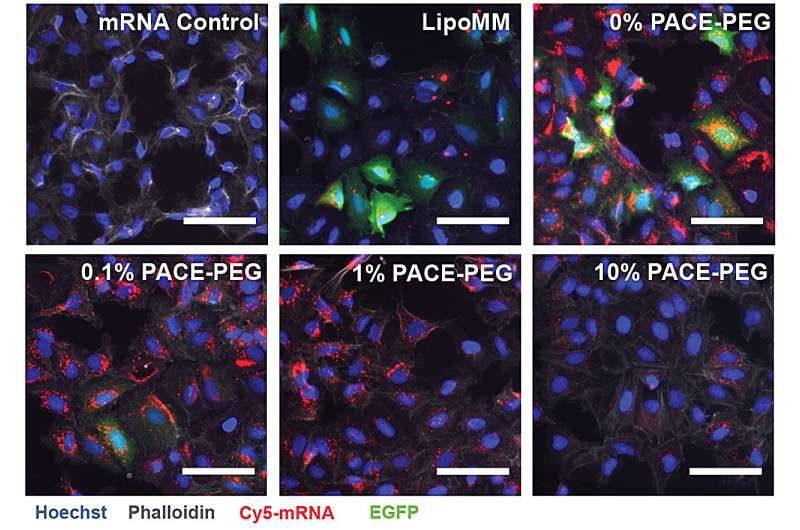
Het Yale-team creëerde PACE-polymeerformuleringen (Polymerized Albumin Conjugates for mRNA Encapsulation) om lokaal mRNA aan de longen af te geven. De onderzoekers optimaliseerden PACE-polyplexen om de mRNA-bescherming, transfectie-efficiëntie en antigeenpresentatie te verbeteren voor effectieve longspecifieke therapeutische en vaccinatiestrategieën.
Om PACE te stabiliseren werd tijdens het enzymatische copolymerisatieproces een geoptimaliseerde verhouding van polyethyleenglycol (PEG) moleculen in de polymeerstructuur geïntegreerd, waardoor de polyplexen werden gestabiliseerd en de belangrijkste kenmerken werden gewijzigd. PEG kon de grootte, oppervlaktelading en andere eigenschappen van de polyplexen beïnvloeden, waardoor ze geschikter werden voor belasting en effectiever werden bij het afleveren van mRNA aan longcellen.
De gestabiliseerde formulering presteerde slecht in een in vitro celkweekexperiment. De onderzoekers merken op dat traditionele celcultuurmethoden geen goede voorspellers zijn van toedieningssystemen, zowel positief als negatief. De omgeving in het lichaam, vooral de longen, werkt heel anders samen dan een verzameling cellen. De mucosale oppervlakken ontbreken bijvoorbeeld, en die oppervlakken zijn precies waar het PACE-PEG-systeem ontworpen is om van te profiteren. De echte test zou in vivo plaatsvinden met een muismodel.
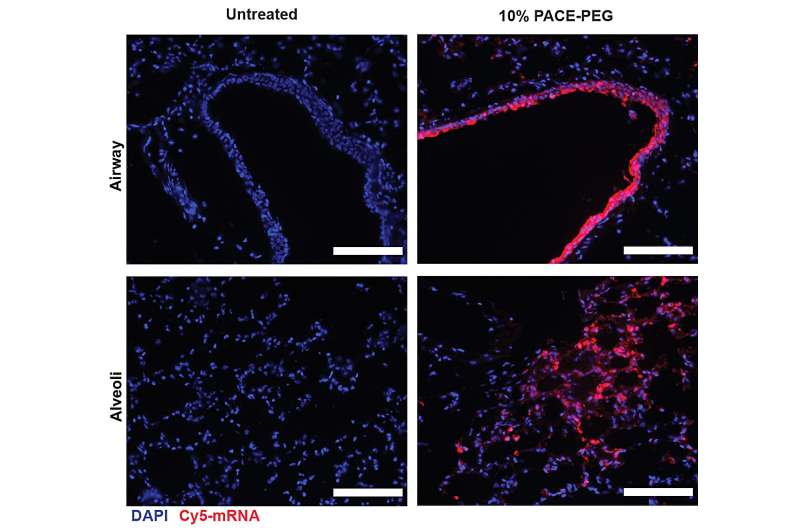
De onderzoekers hebben mRNA dat codeert voor het spike-eiwit van SARS-CoV-2 ingekapseld in PACE en muizen geïnoculeerd die vatbaar zijn voor SARS-CoV-2-infectie. Muizen ontvingen een dosis van 10 μg PACE-mRNA intranasaal toegediend op dag 0 en 28. De ontwikkeling van adaptieve immuniteit in de mediastinale lymfeklieren werd 14 dagen na de boost getest en bevestigd.
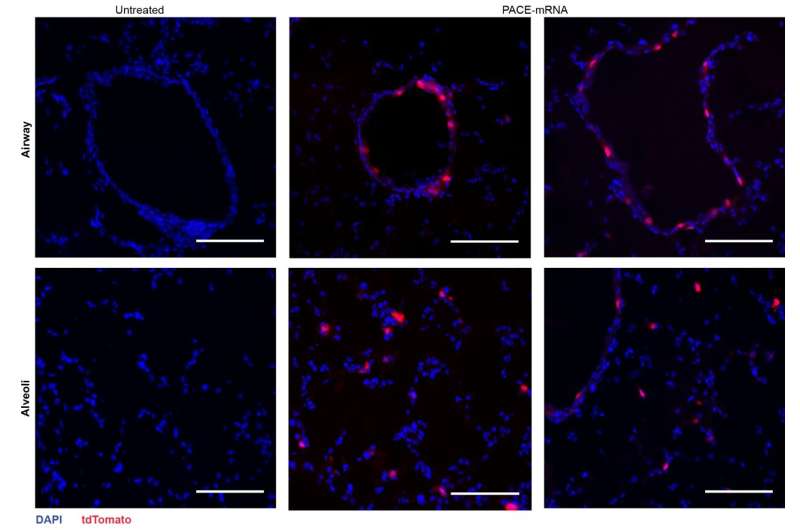
Na beoordeling van de lokale immuunrespons onderzochten de onderzoekers longweefsel, bloedserum en bronchoalveolaire lavagevloeistof op lokale en systemische antigeenspecifieke T-cel- en antilichaamreacties. Transfectie vond voornamelijk plaats in longepitheelcellen en antigeenpresenterende cellen, twee celtypen die relevante doelwitten zijn voor longziekten
De vaccinatie verhoogde met succes het spike-eiwitspecifieke CD8 + T-cellen in het longweefsel en circulerende CD8 + T-cellen in de bloedbaan. CD8 + T-cellen brachten markers tot expressie die indicatief zijn voor weefselresident geheugen. Zowel circulerende als mucosale IgG-antilichamen werden in significant hogere concentraties aangetroffen bij gevaccineerde muizen.
Vervolgens kregen de muizen een dodelijke dosis SARS-CoV-2. PACE-mRNA-vaccinatie verminderde de virale last in de longen aanzienlijk en verbeterde het gewicht en de overleving van de gevaccineerde muizen. Deze bescherming werd toegeschreven aan de spike-eiwitspecifieke immuunrespons die door de vaccinatie werd geïnduceerd.
De controlegroep vertoonde geen bewijs van een spike-eiwitspecifieke immuunrespons en vertoonde geen verminderde virale last of verbeterde overleving na de virale uitdaging.
De studie presenteert PACE-mRNA-polyplexen als een veelbelovende methode voor efficiënte en doelgerichte afgifte van mRNA aan de longen met potentiële voordelen voor zowel therapeutische eiwitexpressie als mucosale vaccinatie tegen respiratoire pathogenen.
De studie illustreert ook het belang van diermodellen, in tegenstelling tot celcultuur alleen, bij het bepalen van effecten in de echte wereld. De positieve resultaten geven aan dat meer onderzoek gerechtvaardigd is, en dat verdere tests op grotere diermodellen gepland zijn.
Meer informatie: Alexandra Suberi et al, Polymeernanodeeltjes leveren mRNA aan de longen voor slijmvliesvaccinatie, Science Translational Medicine (2023). DOI:10.1126/scitranslmed.abq0603
Journaalinformatie: Wetenschappelijk translationele geneeskunde
© 2023 Science X Netwerk
 Belastingregel voor industrie beloont afvang van koolstof
Belastingregel voor industrie beloont afvang van koolstof Verder gaan dan plastic:Taragom als groen polymeer
Verder gaan dan plastic:Taragom als groen polymeer  Molecuul uit de natuur zorgt voor volledig recyclebare polymeren
Molecuul uit de natuur zorgt voor volledig recyclebare polymeren Cryo-force spectroscopie onthult de mechanische eigenschappen van DNA-componenten
Cryo-force spectroscopie onthult de mechanische eigenschappen van DNA-componenten Een getraind AI-systeem leert cellulaire materialen te ontwerpen voor weefselmanipulatie en energieopslag
Een getraind AI-systeem leert cellulaire materialen te ontwerpen voor weefselmanipulatie en energieopslag
 Satelliet vindt een haak van zware regenval in orkaan Juliette
Satelliet vindt een haak van zware regenval in orkaan Juliette Belangrijke landvormen in de VS.
Belangrijke landvormen in de VS.  Hoe het Aquaduct mobiele waterfiltratievoertuig werkt
Hoe het Aquaduct mobiele waterfiltratievoertuig werkt Wat eten steurvissen?
Wat eten steurvissen?
Van de 24 soorten en vijf ondersoorten van de steur, zijn er negen (de schoffel, het meer, groen, bleek, Atlantische Oceaan, wit, golf, kortneus en een zeldzame steur die alleen in Alabama te vinden is) in wateren van Noord-Am
 Stad die nooit slaapt wil het volume verlagen
Stad die nooit slaapt wil het volume verlagen
Hoofdlijnen
- Sonic Kayaks:Milieumonitoring en experimentele muziek door burgers
- Drie manieren waarop genetische diversiteit optreedt tijdens meiose
- Hoe haarverf bijdraagt aan het behoud van de Australische zeeleeuwenpopulatie
- Van Alaska tot Amazonia:de eerste wereldwijde kaarten met eigenschappen die de groei van vegetatie stimuleren
- Onderzoekers onderzoeken effecten van tau-eiwitten op microtubuli in zenuwcellen
- Hoe grassen zoals tarwe in de kou kunnen groeien
- Honden snuffelden vroeger aan zeldzame soorten
- Een niet-verslavende opioïde pijnstiller zonder bijwerkingen
- Wat houdt de genetische continuïteit in?
Je kunt op veel manieren nadenken over genetische continuïteit. In zekere zin verwijst het naar de consistente replicatie van genetische informatie van een oudercel naar twee dochtercellen. Een ander perspec
- Nieuw ontdekte ontwerpregel brengt op de natuur geïnspireerde nanostructuren een stap dichterbij

- Wetenschappers kweken een nieuwe uitdager voor grafeen

- Magnetische eigenschap in een antiferromagnetische halfgeleider maakt lichtmanipulatie op nanoschaal mogelijk

- Steenkool levert veel grafeen-kwantumstippen op

- Gouden en zilveren nanodraden hechten op natuurlijke wijze aan elkaar, blijf sterk
 Infraroodfotodetectoren met hoog rendement die gouden nanostaafjes gebruiken
Infraroodfotodetectoren met hoog rendement die gouden nanostaafjes gebruiken 2 Chinese staatsburgers aangeklaagd voor $ 100 miljoen cryptocurrency-regeling
2 Chinese staatsburgers aangeklaagd voor $ 100 miljoen cryptocurrency-regeling Hoe plantenvirussen kunnen worden gebruikt om ongedierte af te weren en planten gezond te houden
Hoe plantenvirussen kunnen worden gebruikt om ongedierte af te weren en planten gezond te houden Kaas, koeien en mest - systeembenadering maakt moeilijke beslissingen gemakkelijker verteerbaar
Kaas, koeien en mest - systeembenadering maakt moeilijke beslissingen gemakkelijker verteerbaar Hoe werkt een hydraulische dumptruck?
Hoe werkt een hydraulische dumptruck?  Belgische rechtbank veroordeelt Facebook om te stoppen met het volgen van internetgebruikers (Update)
Belgische rechtbank veroordeelt Facebook om te stoppen met het volgen van internetgebruikers (Update) Dinosaurussen unieke botstructuur sleutel tot het dragen van gewicht
Dinosaurussen unieke botstructuur sleutel tot het dragen van gewicht Nieuw raamwerk zorgt voor nauwkeurigheid, efficiëntie bij het identificeren van stopwoorden
Nieuw raamwerk zorgt voor nauwkeurigheid, efficiëntie bij het identificeren van stopwoorden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

