
Wetenschap
Een baanbrekende methode om de meest bruikbare nanodeeltjes voor medicijnen te screenen
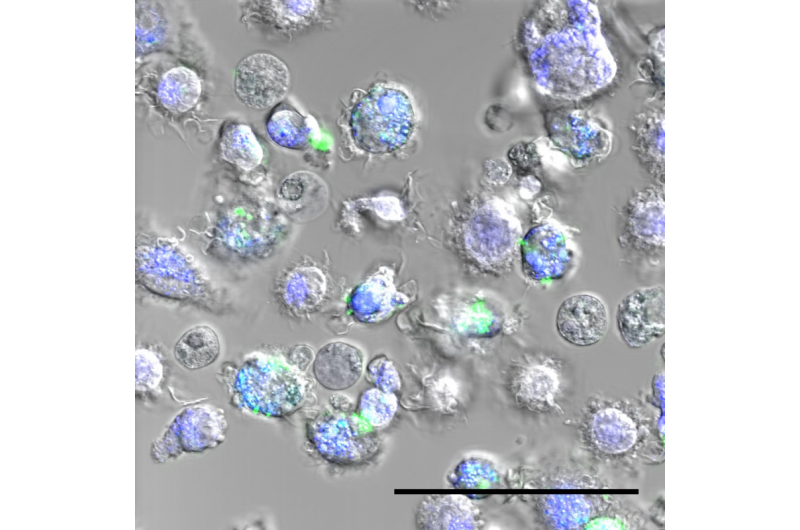
Macrofagen met nanodeeltjes, in het groen. Krediet:Laboratoire Bourquin – UNIFR/UNIGE
Het gebruik van nanodeeltjes - kleine, elementen ter grootte van een virus die onder laboratoriumomstandigheden zijn ontwikkeld, komen steeds vaker voor in de wereld van de medische biologie. Deze snel evoluerende technologie biedt hoop voor veel medische toepassingen, of het nu gaat om diagnose of therapieën. In de oncologie, bijvoorbeeld, de groeiende hoeveelheid onderzoek suggereert dat, dankzij nanodeeltjes, behandeling zal spoedig nauwkeuriger worden, effectiever en minder pijnlijk voor de patiënten. Echter, de manier waarop nanodeeltjes interageren met het immuunsysteem bleef tot voor kort onduidelijk en onvoorspelbaar, hun potentieel medisch gebruik te beperken. Vandaag, onderzoekers van de universiteiten van Genève (UNIGE) en Fribourg (UNIFR), Zwitserland, dicht bij de oplossing van het probleem:ze hebben een snelle screeningmethode bedacht om de meest veelbelovende nanodeeltjes te selecteren, waardoor de ontwikkeling van toekomstige behandelingen versneld wordt. In minder dan een week, ze kunnen bepalen of nanodeeltjes al dan niet compatibel zijn met het menselijk lichaam - een analyse die voorheen enkele maanden werk vergde. Deze ontdekking, die wordt beschreven in het tijdschrift nanoschaal , zou wel eens kunnen leiden tot de snelle, veilige en goedkopere ontwikkeling van nanotechnologie toegepast op geneeskunde.
Nanodeeltjes meten tussen de één en 100 nanometer, ongeveer zo groot als een virus. Omdat ze zo klein zijn, hebben ze het potentieel om te worden gebruikt in een breed scala aan medische toepassingen:dienen als markers voor diagnose, bijvoorbeeld, of het afleveren van therapeutische moleculen op de exacte plek in het lichaam waar het medicijn moet werken. Echter, alvorens te worden toegepast op het medische gebied, nanodeeltjes moeten bewijzen (i) dat ze veilig zijn voor het menselijk lichaam en (ii) dat ze het immuunsysteem kunnen omzeilen zodat ze effect kunnen hebben. "Onderzoekers kunnen jaren bezig zijn met het ontwikkelen van een nanodeeltje, zonder te weten welke impact het zal hebben op een levend organisme, " legt Carole Bourquin uit, hoogleraar geneeskunde en bètafaculteiten aan UNIGE en projectleider. "Er was dus een reële behoefte om een effectieve screeningmethode te ontwerpen die aan het begin van het ontwikkelingsproces kon worden geïmplementeerd. Inderdaad, als de nanodeeltjes niet compatibel zijn, meerdere jaren van onderzoek werden gewoon weggegooid."
Macrofagen orkestreren de immuunrespons
Wanneer een vreemd element - een vreemd element - het lichaam binnenkomt, het immuunsysteem wordt geactiveerd. Macrofagen bevinden zich altijd in de frontlinie, grote cellen die indringers "opnemen" en de immuunrespons veroorzaken. Nanodeeltjes vormen geen uitzondering op deze regel. De manier waarop macrofagen reageren op het onderzochte nanodeeltje voorspelt vervolgens de biocompatibiliteit van het product. "Als je een nieuw deeltje begint te ontwikkelen, het is erg moeilijk om ervoor te zorgen dat het recept elke keer precies hetzelfde is, " wijst Inès Mottas aan, de eerste auteur. "Als we verschillende batches testen, de resultaten kunnen verschillen. Vandaar ons idee om een manier te vinden om de drie parameters tegelijkertijd - en op hetzelfde monster - te testen om de biocompatibiliteit van het product vast te stellen:de toxiciteit, het vermogen om het immuunsysteem te activeren, en het vermogen van de macrofagen om ze op te nemen."
Het ideale medische nanodeeltje mag daarom niet giftig zijn (het mag de cellen niet doden); mag niet volledig worden opgenomen door de macrofagen (zodat het zijn handelingsvermogen behoudt); en zou de activering van het immuunsysteem moeten beperken (om nadelige bijwerkingen te voorkomen).
De drie belangrijkste elementen tegelijk evalueren
Tot nu, het evalueren van de biocompatibiliteit van nanomaterialen was een moeizame taak die enkele maanden in beslag nam en reproduceerbaarheidsproblemen opleverde, aangezien niet alle tests op dezelfde partij deeltjes werden uitgevoerd. Professor Bourquin en haar team gebruikten flowcytometrie om op een veilige en gestandaardiseerde manier een diagnose te stellen van de drie essentiële elementen, en in recordtijd. "De macrofagen worden 24 uur lang in contact gebracht met de nanodeeltjes, en worden vervolgens voor de laserstralen geleid. De fluorescentie die door de macrofagen wordt uitgezonden, maakt het mogelijk ze te tellen en hun activeringsniveaus te karakteriseren. Omdat de deeltjes zelf fluorescerend zijn, we kunnen ook de hoeveelheid meten die door de macrofagen wordt ingenomen. Ons proces betekent dat we de drie elementen tegelijkertijd kunnen testen, en we hebben maar een heel kleine hoeveelheid deeltjes nodig, " vervolgt Mottas. "We kunnen binnen twee of drie dagen een uitgebreide diagnose van het aan ons voorgelegde nanodeeltje krijgen."
De in Genève en Freiburg ontwikkelde methode maakt deel uit van het werk dat is uitgevoerd binnen de National Centres of Competence in Research (NCCR) "Bio-Inspired Materials", en is al een groot succes bij wetenschappers die ernaar streven nieuwe deeltjes te ontwikkelen. Het focust hun werk door hen in staat te stellen snel de meest veelbelovende deeltjes te selecteren. Naast een financiële impact op de kosten van onderzoek, deze nieuwe aanpak beperkt ook het gebruik van dierproeven. Verder, het opent de deur naar een steeds meer gepersonaliseerde behandeling van bepaalde pathologieën. Bijvoorbeeld, door de nanodeeltjes te testen op tumorcellen die zijn geïsoleerd van een bepaalde patiënt, het zou theoretisch mogelijk moeten zijn om de meest effectieve behandeling te identificeren. Alleen de tijd zal leren of deze hypothese in de praktijk wordt ondersteund.
 Het verschil zien tussen een mannelijke Crappie en een vrouw Crappie
Het verschil zien tussen een mannelijke Crappie en een vrouw Crappie Verschillende soorten Wild Blue Jay Birds
Verschillende soorten Wild Blue Jay Birds  De vulkaanuitbarsting van IJsland in 1783-84 veroorzaakte geen extreme hittegolf
De vulkaanuitbarsting van IJsland in 1783-84 veroorzaakte geen extreme hittegolf 40 procent van Oahu, De stranden van Hawaï zouden tegen het midden van de eeuw verloren kunnen gaan
40 procent van Oahu, De stranden van Hawaï zouden tegen het midden van de eeuw verloren kunnen gaan Nanoplastics hopen zich op in mariene organismen en kunnen schadelijk zijn voor aquatische voedselketens
Nanoplastics hopen zich op in mariene organismen en kunnen schadelijk zijn voor aquatische voedselketens
Hoofdlijnen
- De belangrijkste componenten van het skeletsysteem
- De locatie van ribosomen in een cel
- Een driedimensionaal DNA-model maken voor de biologie van de middelbare school
Door een model van een DNA-helix in de klas te bouwen, kunnen studenten de constructie van DNA beter visualiseren en meer te weten komen over de levengevende genetische
- Radartracking onthult hoe bijen een route tussen bloemen ontwikkelen
- Domme mensen zijn verrassend zelfverzekerd
- Genetische instructies van moeder bepalen het patroon voor embryonale ontwikkeling
- Tornado's Effecten op mensen
- Wat is de eerste stap in het decoderen van genetische berichten?
- DropSynth, een eenpotsbenadering van gensynthese
- Voorbij grafeen:controlerende eigenschappen van 2D-materialen

- Beeldvormingstechniek voor unieke weergaven van afzonderlijke moleculen die conventionele methoden niet kunnen evenaren

- Antioxidantverbindingen bootsen effectieve grafeenmiddelen na, potentieel voor therapieën laten zien

- Brandstofvrije nanomotor wordt aangedreven door ultrageluid en magnetische velden
- Microprocessors op basis van atomair dunne materialen zijn veelbelovend voor de evolutie van traditionele processors

 Grafeen presteert beter dan koolstofnanobuisjes voor het creëren van sterkere, Meer scheurbestendige materialen
Grafeen presteert beter dan koolstofnanobuisjes voor het creëren van sterkere, Meer scheurbestendige materialen Sedimentkernen duiden op meer zware regenval in warme periodes en minder klimaatvariabiliteit in koude periodes
Sedimentkernen duiden op meer zware regenval in warme periodes en minder klimaatvariabiliteit in koude periodes Data-relay-satelliet klaar voor service
Data-relay-satelliet klaar voor service Chemici creëren de ultieme natuurlijke zonnebrandcrème
Chemici creëren de ultieme natuurlijke zonnebrandcrème Segregatie van luchtvaartklassen vergroot de kans op incidenten met luchtaanvallen
Segregatie van luchtvaartklassen vergroot de kans op incidenten met luchtaanvallen  Nieuwe studie meet UV-filters in zeewater en koralen uit Hawaii
Nieuwe studie meet UV-filters in zeewater en koralen uit Hawaii NASA's stormgedempte rover markeert 15e verjaardag op Mars
NASA's stormgedempte rover markeert 15e verjaardag op Mars Welke aanpassingen hebben vissen?
Welke aanpassingen hebben vissen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

