
Wetenschap
Wat is de aantrekkingskracht tussen deeltjes in een vloeistof?
Er zijn verschillende soorten intermoleculaire krachten, waaronder:
* waterstofbinding: Dit is het sterkste type intermoleculaire kracht en treedt op wanneer een waterstofatoom wordt gebonden aan een sterk elektronegatief atoom zoals zuurstof, stikstof of fluor. Dit creëert een sterke dipool-dipool interactie.
* Dipole-dipole interacties: Deze treden op tussen polaire moleculen, waarbij het ene uiteinde van het molecuul een gedeeltelijke positieve lading heeft en het andere uiteinde een gedeeltelijke negatieve lading heeft. Deze gedeeltelijke ladingen trekken elkaar aan.
* Dispersietroepen in Londen: Dit zijn het zwakste type intermoleculaire kracht en treden op tussen alle moleculen, zelfs niet-polaire. Ze komen voort uit tijdelijke fluctuaties in elektronenverdeling rond de moleculen.
* ion-dipool interacties: Deze komen voor tussen een ion en een polair molecuul. Het ion zal worden aangetrokken tot het tegengesteld geladen uiteinde van het polaire molecuul.
De sterkte van deze krachten bepaalt veel van de eigenschappen van vloeistoffen, zoals hun kookpunt, viscositeit en oppervlaktespanning.
Hier is een eenvoudige manier om erover na te denken:
* Sterkere intermoleculaire krachten: Leiden tot hogere kookpunten, hogere viscositeit en hogere oppervlaktespanning. Dit komt omdat de moleculen sterker tot elkaar worden aangetrokken en meer energie nodig hebben om deze krachten te overwinnen.
* Zwakkere intermoleculaire krachten: Leiden tot lagere kookpunten, lagere viscositeit en lagere oppervlaktespanning. De moleculen zijn gemakkelijker gescheiden.
Laat het me weten als je meer wilt weten over specifieke intermoleculaire krachten!
Hoofdlijnen
- Organismen wiens cellen geen zichtbare kern hebben?
- Is een recessief allel anders dan een dominant allel?
- Waarom komen suggestie organismen op spontaan en worden dan steeds complexer wordende niet -ondersteund door de theorie van natuurlijke selectie?
- Wat draagt niet bij aan de virulentie van een ziekteverwekker?
- Welke prokaryotische cellen hebben?
- Wat is het cluster van cellen die een zich ontwikkelende ei omringen in eierstok genoemd?
- Studie toont aan dat boomspitsen evolutionaire regels overtreden
- Waar komt de mens uit de basis op een theorie?
- Waarom is het belangrijk om resultaten te kunnen reproduceren?
- Cellen gebruiken concentratiegradiënten als kompas
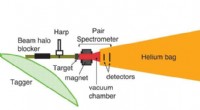
- Verbeterd Primakoff-type experiment geeft verbeterde nauwkeurigheid van pionmeting
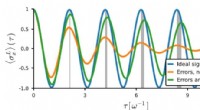
- De bijwerkingen van kwantumfoutcorrectie en hoe ermee om te gaan
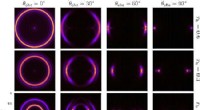
- Onderzoekers stellen nieuwe holografische methode voor om zwarte gaten te simuleren met experiment op tafel
- Sub-picoseconde foton-efficiënte beeldvorming met behulp van sensoren met één foton
 Hoe een tyfoon te voorspellen?
Hoe een tyfoon te voorspellen? Hackers gebruiken angsten voor het coronavirus om u een computervirus te sturen:hoe u ze kunt stoppen
Hackers gebruiken angsten voor het coronavirus om u een computervirus te sturen:hoe u ze kunt stoppen Dipooloriëntatie biedt nieuwe dimensie in superresolutiemicroscopie
Dipooloriëntatie biedt nieuwe dimensie in superresolutiemicroscopie Hoe lokale gemeenschappen afhankelijk zijn van de ivoren palmboom aan de kust van Ecuador
Hoe lokale gemeenschappen afhankelijk zijn van de ivoren palmboom aan de kust van Ecuador  Moleculen uit moedermelk en zeewier suggereren strategieën voor het beheersen van norovirus
Moleculen uit moedermelk en zeewier suggereren strategieën voor het beheersen van norovirus Wetenschappers hebben een materiaal ontwikkeld voor het nieuwe type liquid crystal displays
Wetenschappers hebben een materiaal ontwikkeld voor het nieuwe type liquid crystal displays O T F S E Welke brief is de volgende?
O T F S E Welke brief is de volgende?  Een nieuwe theorie over politieke polarisatie
Een nieuwe theorie over politieke polarisatie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


