
Wetenschap
Hoe staat de kinetische theorie?
Postulaten van de kinetische theorie:
1. materie bestaat uit kleine deeltjes in constante willekeurige beweging. Deze deeltjes kunnen atomen, moleculen of ionen zijn, afhankelijk van de toestand van materie.
2. De deeltjes hebben een verwaarloosbaar volume in vergelijking met het volume van de ruimte die ze bezetten. Dit betekent dat de deeltjes meestal lege ruimte zijn en ze alleen met elkaar inwerken wanneer ze botsen.
3. De deeltjes werken met elkaar op via botsingen, die volkomen elastisch zijn. Dit betekent dat er geen energie wordt verloren tijdens botsingen en de totale kinetische energie van het systeem blijft constant.
4. De gemiddelde kinetische energie van de deeltjes is evenredig met de absolute temperatuur van het systeem. Naarmate de temperatuur stijgt, neemt de gemiddelde kinetische energie van de deeltjes toe en bewegen ze sneller.
Key Concepts:
* Temperatuur: Een maat voor de gemiddelde kinetische energie van de deeltjes in een systeem.
* Druk: Komt voort uit de botsingen van de deeltjes met de wanden van de container.
* diffusie: De beweging van deeltjes uit een gebied van hoge concentratie naar een gebied met een lage concentratie.
* Thermische uitbreiding: De toename van het volume van een stof als gevolg van een toename van de temperatuur.
Toepassingen van de kinetische theorie:
De kinetische theorie wordt gebruikt om een breed scala aan fenomenen te verklaren, waaronder:
* Het gedrag van gassen: De ideale gaswet is afgeleid van de kinetische theorie.
* De eigenschappen van vloeistoffen en vaste stoffen: De kinetische theorie helpt de verschillen in vloeibaarheid en dichtheid tussen vloeistoffen en vaste stoffen te verklaren.
* Warmteoverdracht: De kinetische theorie legt uit hoe warmte wordt overgedragen door geleiding, convectie en straling.
* Chemische reacties: De kinetische theorie geeft inzicht in de snelheid van chemische reacties.
Beperkingen van de kinetische theorie:
De kinetische theorie is een vereenvoudigd model van materie en heeft enkele beperkingen:
* Het is geen rekening gehouden met intermoleculaire krachten. Deze krachten kunnen belangrijk zijn in vloeistoffen en vaste stoffen.
* het gaat ervan uit dat deeltjes puntmassa's zijn. Dit is niet strikt waar, omdat deeltjes een eindige grootte hebben.
* Het gaat ervan uit dat botsingen volkomen elastisch zijn. Dit is niet altijd het geval, vooral bij hoge temperaturen en druk.
Ondanks deze beperkingen is de kinetische theorie een krachtig hulpmiddel om het gedrag van materie op microscopisch niveau te begrijpen.
 Wetenschappers onthullen dynamisch mechanisme van loodvrije viervoudige perovskiet-nanokristallen
Wetenschappers onthullen dynamisch mechanisme van loodvrije viervoudige perovskiet-nanokristallen Nieuw bewijsmateriaal ingediend bij Grenfell Tower Inquiry over bekledingsreactiviteit
Nieuw bewijsmateriaal ingediend bij Grenfell Tower Inquiry over bekledingsreactiviteit De pH van een twee-chemisch mengsel berekenen
De pH van een twee-chemisch mengsel berekenen  Röntgenabsorptiespectra voorspellen uit grafieken
Röntgenabsorptiespectra voorspellen uit grafieken Welke stof heeft een pH -niveau van 9?
Welke stof heeft een pH -niveau van 9?
 Als de opwarming van de aarde stopt, zeeën zullen nog steeds stijgen:studie
Als de opwarming van de aarde stopt, zeeën zullen nog steeds stijgen:studie Wat is het concept van wetenschap tegenwoordig?
Wat is het concept van wetenschap tegenwoordig?  Onderzoekers beoordelen waterveiligheid van Centraal-Aziatische landen
Onderzoekers beoordelen waterveiligheid van Centraal-Aziatische landen Een brandende chemische fabriek is misschien maar het topje van de schade door orkaan Laura in dit gebied van olievelden en industrie
Een brandende chemische fabriek is misschien maar het topje van de schade door orkaan Laura in dit gebied van olievelden en industrie Het geheim van het nabootsen van natuurlijke fouten? Plexiglas en teflon
Het geheim van het nabootsen van natuurlijke fouten? Plexiglas en teflon
Hoofdlijnen
- DNA-strengen zijn anti-parallel - leg uit?
- Wat is de vitamine die wordt omgezet in co-enzym PLP en actief is in het aminozuurmetabolisme?
- Wat zijn de 5 delen van een zaadje?
- Hoe kan het gras op de greens op een golfbaan zo perfect zijn?
- Hoe is cytokinese anders bij planten en dieren?
- Fossielen tonen aan dat er vóór de dinosauriërs een enorm salamanderachtig roofdier met scherpe tanden bestond
- Hoe lijkt de kern van een cel op een gemeentehuis?
- Wat is de nadruk van het menselijke genoomproject?
- Wat is het Human Epigenome Project?
- Phononic SEIRA—verbetering van interacties tussen licht en moleculen via kristalroostervibraties

- Draagbare technologie biedt boost voor nucleaire veiligheid, wapenbeheersing

- Definiëren van de plasmadosis voor mogelijke toekomstige kankerbehandelingen

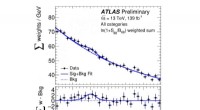
- ATLAS-experiment zoekt naar zeldzaam Higgs-boson vervalt in een foton en een Z-boson
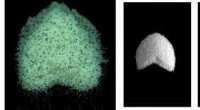
- Onderzoek helpt bij het begrijpen van de dynamiek van duinvorming
 Nieuwe methode om neutronentransportberekeningen te versnellen
Nieuwe methode om neutronentransportberekeningen te versnellen Grafeen komt de stratosfeer binnen
Grafeen komt de stratosfeer binnen Is de Mars Pathfinder een satelliet?
Is de Mars Pathfinder een satelliet?  Hoeveel mijl is een triljoen centimeter?
Hoeveel mijl is een triljoen centimeter?  Wat zijn twee stollingsgesteenten gevormd uit langzaam koelmagma?
Wat zijn twee stollingsgesteenten gevormd uit langzaam koelmagma?  Wat absorbeert gras en water lichtenergie?
Wat absorbeert gras en water lichtenergie?  Hoe formatieve beoordelingen de besluitvorming in de klas stimuleren
Hoe formatieve beoordelingen de besluitvorming in de klas stimuleren  Enkele atomen verbreken de sterkste binding van koolstof
Enkele atomen verbreken de sterkste binding van koolstof
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

