
Wetenschap
Hoe werkt de botsingstheorie?
Botsingstheorie:een spoedcursus in chemische reacties
Botsingstheorie legt uit hoe chemische reacties op moleculair niveau optreden. Het komt neer op twee hoofdideeën:
1. Moleculen moeten botsen om te reageren: Chemische reacties gebeuren wanneer moleculen elkaar tegenkomen. Deze botsing biedt de energie die nodig is om bestaande bindingen te verbreken en nieuwe te vormen. Zie het als een spelletje zwembad - de ballen moeten botsen voor alles wat er gebeurt!
2. Niet alle botsingen leiden tot reacties: Net als in pool resulteert niet elke botsing in een succesvolle reactie. Verschillende factoren beïnvloeden of een botsing effectief zal zijn:
* Activeringsenergie: Dit is de minimale hoeveelheid energie die nodig is om een botsing succesvol te zijn. Zie het als een "drempel" - als de moleculen niet genoeg energie hebben, zullen ze van elkaar stuiteren zonder te reageren.
* oriëntatie: De moleculen moeten in de juiste oriëntatie botsen om de reactie te laten optreden. Stel je voor dat je probeert puzzelstukjes in elkaar te passen - ze moeten goed worden uitgelijnd om te passen.
* Temperatuur: Hogere temperaturen betekenen dat moleculen sneller bewegen en vaker botsen, waardoor de kansen op succesvolle botsingen toeneemt.
* concentratie: Een hogere concentratie reactanten betekent dat er een grotere kans is dat botsingen plaatsvinden.
Hoe werkt het?
1. botsingen: Moleculen zijn constant in beweging en botsen tegen elkaar.
2. Activeringsenergie: Als een botsing voldoende energie heeft om de activeringsenergiebarrière te overwinnen, kan deze doorgaan.
3. reactie: De botsing leidt tot het verbreken van bestaande obligaties en de vorming van nieuwe obligaties, wat resulteert in de producten van de reactie.
Samenvattend:
* Reacties treden op door moleculaire botsingen.
* Niet alle botsingen zijn effectief vanwege activeringsenergie en oriëntatie -eisen.
* Factoren zoals temperatuur en concentratie beïnvloeden de botsfrequentie en succespercentages.
Botsingstheorie biedt een fundamenteel begrip van hoe chemische reacties op moleculair niveau optreden, waardoor de basis wordt gelegd voor het begrijpen van reactiekinetiek en het manipuleren van reactiesnelheden.
 Ecologische energie-accu gemaakt van vanilline
Ecologische energie-accu gemaakt van vanilline Nieuwe technologie voor detectie van pathogenen aangedreven door lasers
Nieuwe technologie voor detectie van pathogenen aangedreven door lasers Onderzoekers verkrijgen decaden, de grootste aceen ooit gesynthetiseerd
Onderzoekers verkrijgen decaden, de grootste aceen ooit gesynthetiseerd Hoe absorbeert en breekt marihuana nucleaire straling af?
Hoe absorbeert en breekt marihuana nucleaire straling af?  Licht stimuleert een nieuwe wending in de synthetische chemie
Licht stimuleert een nieuwe wending in de synthetische chemie
 Wat is een grasland met verspreid bos?
Wat is een grasland met verspreid bos?  Noem twee factoren die ervoor zorgen dat seizoen en klimaat veranderen?
Noem twee factoren die ervoor zorgen dat seizoen en klimaat veranderen?  Wat is de waarde van de wetenschap in Day Today World?
Wat is de waarde van de wetenschap in Day Today World?  Blikseminslagen kunnen op korte termijn dunner worden in de ozonlaag
Blikseminslagen kunnen op korte termijn dunner worden in de ozonlaag NASA ziet post-tropische storm Teddy zware regen veroorzaken boven Oost-Canada
NASA ziet post-tropische storm Teddy zware regen veroorzaken boven Oost-Canada
Hoofdlijnen
- Hoe slapende bacteriën weer tot leven komen
- Lijst met ingekapselde bacteriën
- Waarom zijn vitamines belangrijk voor enzymen en hoe heet deze relatie?
- Uit een onderzoeker die overerving studeerde, bleek dat wanneer zwarte muizen met wit werden gekruist, alle geproduceerde nakomelingen grijs waren, waar is dit een voorbeeld van?
- Speciatie veroorzaakt door het uiteenvallen van continenten zou A. parapatriy B. genenstroom C. allopatry D. sympatry zijn?
- Wat doen de chloroplasten S in een plantencel?
- Wanneer en waarom zijn de menselijke hersenen 3000 jaar geleden kleiner geworden? Mieren kunnen aanwijzingen bevatten
- Welke fasen vormen de interfase van de celcyclus?
- Wat is de bijvoeglijk naamwoord van wetenschap?
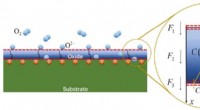
- Presteren onder druk:Modellering van oxidatie in hoogspanningsmaterialen
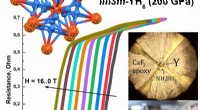
- Wetenschappers hebben een nieuwe supergeleider voor hoge temperaturen gesynthetiseerd
- Het observeren van het pad dat minder wordt afgelegd, verhoogt de kwantumwinst

- Neutronen in cijfers:nieuwe teltechniek zorgt voor ongekende nauwkeurigheid
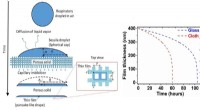
- Poreuze materialen ongunstig voor overleving van coronavirus
 Wat is de ineenstorting van een massale aarde of rotsen uit de berg genoemd?
Wat is de ineenstorting van een massale aarde of rotsen uit de berg genoemd?  Wat is het beeld met de hoogste resolutie ooit vastgelegd door Hubble Telescope?
Wat is het beeld met de hoogste resolutie ooit vastgelegd door Hubble Telescope?  Hoeveel centimeter in 0,345 mm?
Hoeveel centimeter in 0,345 mm?  Wat zou de evenwichtsconcentratie van NO zijn in een gasmengsel dat 1,7 m SO3 0,070 SO2 en 1,3 NO2 bevat als KEQ 10.8 onder die omstandigheden?
Wat zou de evenwichtsconcentratie van NO zijn in een gasmengsel dat 1,7 m SO3 0,070 SO2 en 1,3 NO2 bevat als KEQ 10.8 onder die omstandigheden?  Wat wordt bedoeld met genetische integriteit?
Wat wordt bedoeld met genetische integriteit?  Hoeveel temperatuur heeft de zon?
Hoeveel temperatuur heeft de zon?  Technologische doorbraak in energiezuinige deeltjesversnellers
Technologische doorbraak in energiezuinige deeltjesversnellers Op metaaloxide halfgeleider op nanomembranen gebaseerde multifunctionele elektronica voor draagbare-menselijke interfaces
Op metaaloxide halfgeleider op nanomembranen gebaseerde multifunctionele elektronica voor draagbare-menselijke interfaces
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

