
Wetenschap
Met wat voor soort kracht werkt in een molecuul?
1. Intramoleculaire krachten: Dit zijn de krachten die atomen bij elkaar houden binnen een molecuul. Ze zijn veel sterker dan intermoleculaire krachten.
* Covalente bindingen: Het sterkste type intramoleculaire kracht. Ze omvatten het delen van elektronen tussen atomen. Voorbeelden zijn de bindingen in water (H₂o) en methaan (CH₄).
* ionische bindingen: Deze omvatten de elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen. Ze worden meestal niet gevonden in moleculen, maar eerder tussen moleculen in ionische verbindingen.
* metalen bindingen: Deze komen voor in metalen en omvatten een "zee" van gedelokaliseerde elektronen die worden gedeeld door alle metaalatomen.
2. intermoleculaire krachten: Dit zijn de krachten die bestaan * tussen * moleculen. Ze zijn veel zwakker dan intramoleculaire krachten, maar spelen nog steeds een belangrijke rol bij het bepalen van de fysieke eigenschappen van een stof, zoals smeltpunt en kookpunt.
* waterstofbinding: Een sterk type dipool-dipoolinteractie dat optreedt wanneer een waterstofatoom wordt gebonden aan een sterk elektronegatief atoom, zoals zuurstof of stikstof. Dit is cruciaal voor de eigenschappen van water.
* Dipole-dipole interacties: Komen tussen polaire moleculen op als gevolg van de aantrekkingskracht van tegengesteld geladen uiteinden.
* Dispersietroepen in Londen: Dit zijn tijdelijke, zwakke attracties die optreden tussen alle moleculen als gevolg van onmiddellijke fluctuaties in elektronenverdeling. Ze zijn de zwakste intermoleculaire kracht.
Samenvattend, de krachten die een molecuul bij elkaar houden worden intramoleculaire krachten genoemd , voornamelijk covalente bindingen . De krachten die werken tussen moleculen worden intermoleculaire krachten genoemd , die veel zwakker zijn en waterstofbinding, dipool-dipoolinteracties en dispersiekrachten in Londen omvatten .
 We zochten naar ontbrekend plastic afval in Zuid-Afrika. Dit hebben we gevonden
We zochten naar ontbrekend plastic afval in Zuid-Afrika. Dit hebben we gevonden Terugkerend naar de wortels van de landbouw in de strijd tegen de kever van een miljard dollar
Terugkerend naar de wortels van de landbouw in de strijd tegen de kever van een miljard dollar Nieuw model laat zien hoe vruchtwisseling plantenplagen helpt bestrijden
Nieuw model laat zien hoe vruchtwisseling plantenplagen helpt bestrijden  Waterbedrijven zijn belangrijkste oorzaak van vervuiling door microplastics in Britse rivieren
Waterbedrijven zijn belangrijkste oorzaak van vervuiling door microplastics in Britse rivieren Is de aarde 84 miljoen jaar geleden op zijn kant gevallen?
Is de aarde 84 miljoen jaar geleden op zijn kant gevallen?
Hoofdlijnen
- Het niveau van eiwitstructuur dat de sequentie -aminozuren is?
- Hoe heet het orgel dat spijsverteringssappen vrijgeeft in dunne darm?
- Nieuwe studie biedt mechanistische inzichten in hoe gentranscriptie wordt gereguleerd in zoogdiercellen
- Gezocht:vrijwillige schutters om kudde bizons in Grand Canyon uit te dunnen (update)
- Lovelorn koala gepakt na ontsnapping uit dierentuin op jacht naar partner
- Wat zijn de functies van verschillende witte bloedcellen?
- Een pinguïn met een onconventionele roep inspireert onderzoekers om de manier waarop ze pinguïns bestuderen te veranderen
- Studie onderzoekt langere levensduur door gebrekkige RNA-verwerking
- Wat is de naam van macromoleculen die uo DNA maakt?
- Nieuwe techniek geeft vijvers op Arctisch zee-ijs nauwkeuriger weer

- Begrijpen wat er in vloeibare druppeltjes gebeurt

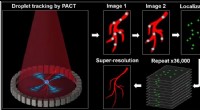
- In vivo fotoakoestische computertomografie met superresolutie door lokalisatie van enkelgekleurde druppeltjes
- Drijvende en stuiterende deeltjes kunnen de stabiliteit in fusieplasma's handhaven

- Controle van de optische eigenschappen van vaste stoffen met akoestische golven

 Wat is het gebruik van beryllium?
Wat is het gebruik van beryllium?  Welke functie zou u vinden rond convergerende tektonische platen?
Welke functie zou u vinden rond convergerende tektonische platen?  Een schoner brandend alternatief voor kooktoestellen opschalen
Een schoner brandend alternatief voor kooktoestellen opschalen Noem de drie soorten rotsen?
Noem de drie soorten rotsen?  Gebruikten microben om giftig elektronisch afval op te ruimen - hier is hoe
Gebruikten microben om giftig elektronisch afval op te ruimen - hier is hoe Wanneer werd Mt. Everest ontdekt?
Wanneer werd Mt. Everest ontdekt?  Wat is energie van licht of belemmering?
Wat is energie van licht of belemmering?  Wat onderscheidt elektromagnetische golven van mechanische golven?
Wat onderscheidt elektromagnetische golven van mechanische golven?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

