
Wetenschap
Welk model gebruiken wetenschappers om te praten over de banen van elektronen in een atoom?
1. Bohr -model: Dit model, voorgesteld door Niels Bohr in 1913, is een vereenvoudigd model dat elektronen weergeeft die rond de kern zijn in vaste, cirkelvormige paden die orbits worden genoemd. Het is een handige manier om elektronengedrag te visualiseren, maar het heeft beperkingen omdat het de complexe kwantumkarakter van elektronen niet volledig verklaart.
2. Kwantummechanisch model: Dit is het meer accurate en complexe model. Het beschrijft elektronen niet als een baandeeltjes, maar als waarschijnlijkheidsverdelingen Binnen regio's genaamd orbitalen . Deze orbitalen zijn driedimensionale ruimtes waar een grote kans is om een elektron te vinden. Dit model is gebaseerd op het idee dat elektronen golfachtige eigenschappen hebben en hun exacte locatie kan niet precies worden bepaald.
Het antwoord is dus: Wetenschappers gebruiken voornamelijk het kwantummechanische model om te praten over het gedrag van elektronen in atomen. Ze kunnen echter ook het bohr -model gebruiken als een vereenvoudigde manier om het concept van elektronenbanen te visualiseren, vooral in inleidende discussies.
 Hoe de viscositeit van olie te verhogen
Hoe de viscositeit van olie te verhogen  Ontwikkelen van een breed temperatuurbereik en hoogspannings waterige MXene planaire micro-supercondensatoren
Ontwikkelen van een breed temperatuurbereik en hoogspannings waterige MXene planaire micro-supercondensatoren Wat is de temperatuur die wordt gebruikt op laboratoriumthermometers?
Wat is de temperatuur die wordt gebruikt op laboratoriumthermometers?  Waarom metalen goede elektrische geleiders?
Waarom metalen goede elektrische geleiders?  hoe kunnen we kaliumdichromaat scheiden van water]?
hoe kunnen we kaliumdichromaat scheiden van water]?
 Aardworm Phylum Kenmerken
Aardworm Phylum Kenmerken Wat beschreef de wetenschappers het beste die hebben bijgedragen aan de huidige hoeveelheid kennis?
Wat beschreef de wetenschappers het beste die hebben bijgedragen aan de huidige hoeveelheid kennis?  Versteende vissen kunnen wijzen op rijke afzettingen van waardevolle zeldzame aardmetalen
Versteende vissen kunnen wijzen op rijke afzettingen van waardevolle zeldzame aardmetalen Gevaarlijke rokerige lucht sluit Yosemite af in het hoogseizoen voor toeristen
Gevaarlijke rokerige lucht sluit Yosemite af in het hoogseizoen voor toeristen Waarom komen wijnstokken zo vaak voor in regenwouden?
Waarom komen wijnstokken zo vaak voor in regenwouden?
Hoofdlijnen
- Competitie (biologie): definitie, types en voorbeelden
- Wat zijn de vier macromoleculen van het leven?
- Wat is een gehinderde nucleofiel?
- Wat betekent scheiden in de menselijke biologie?
- Een sekseverschil in sportinteresse:wat zegt de evolutie?
- Het 'lees-schrijf'-mechanisme van de cel:Onderzoekers ontdekken hoe instructies voor genexpressie worden doorgegeven
- Wat is een geselecteerde groep cellen?
- Oogstkracht:hoe theeplanten ziekten bestrijden terwijl ze zacht blijven
- Cannabis kweken met moderne wetenschap en technologie
- Microgolven buigen en frequenties verbieden met gesimuleerde metamaterialen

- Ultrasnelle camera neemt 1 biljoen frames per seconde van transparante objecten en verschijnselen
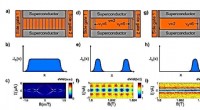
- Quantum Hall-gebaseerd supergeleidend interferentieapparaat
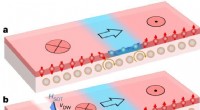
- Onderzoekers observeren ladingsstreepkristalfase in een isolerende cuprate

- Een volledig elektrische magnetische logische poort
 Grote door de wind aangedreven oceaanstromingen verschuiven naar de polen
Grote door de wind aangedreven oceaanstromingen verschuiven naar de polen Welke planeet draait met de klok mee?
Welke planeet draait met de klok mee?  CERN meet voor het eerst de gekoppelde resonantiestructuur die deeltjesverlies in versnellers kan veroorzaken
CERN meet voor het eerst de gekoppelde resonantiestructuur die deeltjesverlies in versnellers kan veroorzaken  Hoe verschilt het heliocentrische model van het geocentische model?
Hoe verschilt het heliocentrische model van het geocentische model?  Welk gebied ervaart de kleinste seizoensgebonden variatie in zonne -energie -energie?
Welk gebied ervaart de kleinste seizoensgebonden variatie in zonne -energie -energie?  10 ongebruikelijke dingen die mensen de ruimte in hebben gelanceerd
10 ongebruikelijke dingen die mensen de ruimte in hebben gelanceerd  Kenmerken van de jachtluipaard
Kenmerken van de jachtluipaard  Waarom exploderen azijn en zuiveringszout als ze met elkaar gemengd worden?
Waarom exploderen azijn en zuiveringszout als ze met elkaar gemengd worden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

