
Wetenschap
Hoeveel soorten van der Waals -krachten bestaan er?
1. London Dispersion Forces (LDF): Dit zijn het zwakste type en komen op tussen alle moleculen, zelfs niet -polaire. Ze komen voort uit tijdelijke schommelingen in elektronenverdeling, waardoor tijdelijke dipolen ontstaan.
2. Dipole-dipole krachten: Deze treden op tussen polaire moleculen met permanente dipolen. Het positieve uiteinde van het ene molecuul wordt aangetrokken tot het negatieve uiteinde van het andere.
3. Waterstofbinding: Dit is een speciaal type dipool-dipoolinteractie dat optreedt tussen een waterstofatoom dat is gebonden aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor) en een elektronpaar op een ander molecuul. Het is het sterkste type van der Waals -kracht.
Hoewel dit de drie belangrijkste typen zijn, is het belangrijk op te merken dat er ook subtypen zijn binnen deze categorieën, zoals:
* Dipool-geïnduceerde dipoolkrachten: Deze treden op wanneer een polair molecuul een tijdelijke dipool induceert in een niet -polair molecuul.
* onmiddellijke dipool-geïnduceerde dipoolkrachten: Dit is een andere naam voor dispersietroepen in Londen.
Het is ook belangrijk om te onthouden dat deze krachten zwak zijn Vergeleken met andere soorten binding, zoals covalente of ionische bindingen.
 Een betere hiv-test
Een betere hiv-test Wat is de fysische chemie?
Wat is de fysische chemie?  Video:Wat is de chemie achter ringworm?
Video:Wat is de chemie achter ringworm? Een betrouwbare experimentele benchmark voor het voorspellen van de kristalstructuur van farmaceutische geneesmiddelen
Een betrouwbare experimentele benchmark voor het voorspellen van de kristalstructuur van farmaceutische geneesmiddelen  Wat zijn de verschillende zuurstoftanks met kleurcoderingen en welke betekenis hebben hun kleuren?
Wat zijn de verschillende zuurstoftanks met kleurcoderingen en welke betekenis hebben hun kleuren?
 Enorme tsunami treft Oman 1 000 jaar geleden
Enorme tsunami treft Oman 1 000 jaar geleden Studie schat meer dan 100, 000 gevallen van kanker kunnen het gevolg zijn van verontreinigingen in leidingwater
Studie schat meer dan 100, 000 gevallen van kanker kunnen het gevolg zijn van verontreinigingen in leidingwater Methaanemissies van olie- en gasexploratie worden ondergerapporteerd
Methaanemissies van olie- en gasexploratie worden ondergerapporteerd San Francisco verslikt zich in giftige lucht terwijl bosbranden woeden
San Francisco verslikt zich in giftige lucht terwijl bosbranden woeden Nieuwe studie laat zien hoe methaan door ijzige barrières op de zeebodem breekt
Nieuwe studie laat zien hoe methaan door ijzige barrières op de zeebodem breekt
Hoofdlijnen
- Waarom is stikstof belangrijk voor de mens?
- Wat is de functie van een pellicle?
- nieuwe studie, detaillering van 22 jaar durend wereldwijd burgerwetenschappelijk project werpt licht op raadselachtige bedreigde walvishaaien
- Hoe zou de mondiale voedselproductie kunnen instorten?
- Zou de micro-ecologie worden beschadigd door een plastic film die een schadelijk bodeminsect doodt?
- Wat zijn eiwitstaven die helpen bij cellulaire beweging?
- Wetenschappers ontwikkelen microben om herinneringen aan hun omgeving te vormen
- Wat zijn vier namen van macromoleculen?
- Bevindingen suggereren hoe zwemmende cellen biofilms vormen op oppervlakken
- Gezichtsmasker constructie, materialen zijn belangrijk voor het bevatten van hoesten, niesdruppels
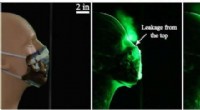
- Quantumtechnologieën:nieuwe inzichten in supergeleidende processen

- Supergeleiding met tweevoudige symmetrie:nieuw bewijs voor topologische supergeleider SrxBi2Se3
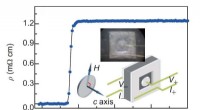
- Supergeleidende spoelen voor contactloze krachtoverbrenging in het kilowattbereik

- Krijgen oer-magnetische-veldtheorieën een wending?

 Welk type binding wordt gevormd tussen atomen vaste kobalt?
Welk type binding wordt gevormd tussen atomen vaste kobalt?  Institutionele omgevingen vangen gehandicapte geowetenschappers tussen een rots en een werkplek
Institutionele omgevingen vangen gehandicapte geowetenschappers tussen een rots en een werkplek De blauwe economie is meer dan middelen:ze moet zich richten op sociale rechtvaardigheid en bestuur
De blauwe economie is meer dan middelen:ze moet zich richten op sociale rechtvaardigheid en bestuur Een dammodel maken voor een wetenschapsproject
Een dammodel maken voor een wetenschapsproject  Een orbitale dans kan helpen om oceanen op ijzige werelden te behouden
Een orbitale dans kan helpen om oceanen op ijzige werelden te behouden Schokkende economie
Schokkende economie Wetenschappers draaien evolutionaire klok terug om CO2-tolerante microalgen te ontwikkelen
Wetenschappers draaien evolutionaire klok terug om CO2-tolerante microalgen te ontwikkelen Nieuwe techniek meet de psilocybine potentie van paddenstoelen
Nieuwe techniek meet de psilocybine potentie van paddenstoelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

