
Wetenschap
Nieuwe microscopiemethode biedt ongekende kijk op amyloïde eiwitstructuur
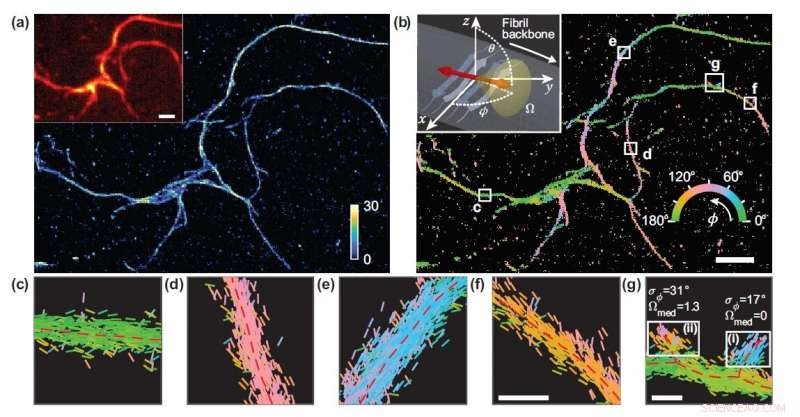
Onderzoekers ontwikkelden een microscopietechniek die de locatie en oriëntatie van afzonderlijke moleculen meet en gebruikten deze om de structurele details van amyloïde eiwitaggregaten te bestuderen. (a) Single-molecuul lokalisatie microscopie afbeelding van een netwerk van amyloïde aggregaten. (b) Afbeelding met Nijlrode bindingsoriëntaties aan amyloïde oppervlakken, kleurgecodeerd volgens de gemiddelde oriëntatie gemeten in elke bak. (c-g) individuele oriëntatiemetingen gelokaliseerd langs fibril-ruggengraat in de witte vakken in (b). De lijnen zijn georiënteerd en kleurgecodeerd volgens de richting van de geschatte hoek. Horizontale witte schaalbalken zijn lengtemarkeringen, 1 micron in (a), (b) en 100 nm in (f), (G). Krediet:Tianben Ding, Tintelende Wu en Matthew D. Lew, Washington University in St. Louis
Neurodegeneratieve ziekten zoals de ziekte van Alzheimer en Parkinson gaan vaak gepaard met amyloïde eiwitten in de hersenen die samengeklonterd of verkeerd gevouwen zijn. Een nieuw ontwikkelde techniek die de oriëntatie van afzonderlijke moleculen meet, maakt het mogelijk om optische microscopie te gebruiken, Voor de eerste keer, om details op nanoschaal over de structuren van deze problematische eiwitten te onthullen.
Onderzoekers van de Washington University in St. Louis beschrijven hun nieuwe aanpak in optiek , Het tijdschrift van de Optical Society.
"Neurodegeneratieve aandoeningen zoals de ziekte van Alzheimer en Parkinson zijn de belangrijkste doodsoorzaken over de hele wereld, " zei Tianben Ding, co-eerste auteur van het nieuwe artikel. "We hopen dat onze beeldvormingsbenadering met één molecuul oriëntatie nieuwe inzichten kan bieden in de amyloïdestructuur en mogelijk kan bijdragen aan de toekomstige ontwikkeling van effectieve therapieën tegen deze ziekten."
Biologische en chemische processen in de hersenen worden aangedreven door gecompliceerde bewegingen en interacties tussen moleculen. Hoewel de meeste amyloïde-eiwitten niet-toxisch kunnen zijn, het verkeerd vouwen van zelfs maar een paar zou uiteindelijk veel neuronen kunnen doden.
"We hebben beeldvormingstechnologieën nodig die deze moleculaire bewegingen in levende systemen kunnen bekijken om de fundamentele biologische mechanismen van ziekte te begrijpen, " legde Matthew D. Lew uit, leider van het onderzoeksteam. "Amyloïde en prion-achtige ziekten zoals de ziekte van Alzheimer, Parkinson en diabetes zijn onze eerste doelwitten voor deze technologie, maar we zien het ook op veel andere gebieden worden toegepast."
De beste microscoop selecteren
Lew's lab heeft verschillende superresolutiemicroscopiemethoden met één molecuul ontwikkeld die de oriëntatie en locatie van fluorescerende moleculen die aan afzonderlijke eiwitten zijn bevestigd, meten. De oriëntatie-informatie wordt verkregen door niet alleen de locatie van fluorescentie in het monster te meten, maar ook de kenmerken van dat licht, zoals polarisatie, die meestal worden genegeerd in de meeste andere microscopiebenaderingen.
in hun optiek artikel, de onderzoekers beschreven een prestatiestatistiek die ze hebben ontworpen om te karakteriseren hoe gevoelig verschillende microscopen oriëntaties van fluorescerende moleculen kunnen meten. Met behulp van de nieuwe prestatie-indicator, de onderzoekers ontdekten dat een microscoop die fluorescentielicht splitst in twee polarisatiekanalen (x en y) superieure en praktische oriëntatiemetingen biedt.
"De metriek die we hebben ontwikkeld, berekent de prestaties van een bepaald microscoopontwerp 1, 000 keer sneller dan voorheen, " zei Tingting Wu, co-eerste auteur van het werk. "Door de oriëntaties te meten van afzonderlijke moleculen gebonden aan amyloïde aggregaten, de geselecteerde microscoop stelde ons in staat om verschillen in amyloïde structuurorganisatie in kaart te brengen die niet kunnen worden gedetecteerd door standaard lokalisatiemicroscopen."
Aangezien er geen kunstmatige link is tussen de fluorescerende sondes en amyloïde oppervlakken, de bindingsoriëntatie van de sondes aan de amyloïde oppervlakken geeft informatie over hoe het amyloïde-eiwit zelf is georganiseerd. De onderzoekers kwantificeerden hoe de oriëntaties van fluorescerende moleculen varieerden elke keer dat er een aan een amyloïde-eiwit werd bevestigd. Verschillen in dit bindingsgedrag kunnen worden toegeschreven aan structuurverschillen tussen amyloïde aggregaten. Omdat de methode informatie over één molecuul biedt, de onderzoekers konden nanoschaalverschillen tussen amyloïde structuren waarnemen zonder de details van lokale kenmerken te middelen.
Mogelijkheden voor langdurige studies
"We zijn van plan de methode uit te breiden om veranderingen op nanoschaal binnen en tussen amyloïdestructuren te volgen terwijl ze zich gedurende uren tot dagen organiseren, " zei Ding. "Langdurige studies van amyloïde aggregaten kunnen nieuwe correlaties onthullen tussen hoe amyloïde eiwitten zijn georganiseerd en hoe snel ze groeien of spontaan oplossen."
De onderzoekers merken op dat de opstelling die ze gebruikten voor oriëntatie-lokalisatiemicroscopie bestond uit in de handel verkrijgbare onderdelen die toegankelijk zijn voor iedereen die superresolutiemicroscopie met één molecuul uitvoert. Hun analysecode is beschikbaar op https://github.com/Lew-Lab/RoSE-O.
"In optische microscopie en beeldvorming, wetenschappers en ingenieurs hebben de grenzen van beeldvorming verlegd om sneller te zijn, dieper sonderen en een hogere resolutie hebben, " zei Lew. "Ons werk laat zien dat men licht kan werpen op fundamentele processen in de biologie door, in plaats daarvan, gericht op moleculaire oriëntatie, die details kan onthullen over de innerlijke werking van de biologie die niet kunnen worden gevisualiseerd door traditionele microscopie."
 Methode om medicijnstabiliteit te voorspellen kan leiden tot effectievere medicijnen
Methode om medicijnstabiliteit te voorspellen kan leiden tot effectievere medicijnen Onderzoekers ontdekken hoe de enzymomgeving de snelheid en richting van een reactie verandert
Onderzoekers ontdekken hoe de enzymomgeving de snelheid en richting van een reactie verandert Scheurvoortplanting is asymmetrisch in polaire materialen
Scheurvoortplanting is asymmetrisch in polaire materialen Heterometallische koper-aluminium superatoom ontdekt
Heterometallische koper-aluminium superatoom ontdekt Onderzoek bevestigt dat verwarming de sterkte van een type hydrogel kan vergroten
Onderzoek bevestigt dat verwarming de sterkte van een type hydrogel kan vergroten
Hoofdlijnen
- DNA-modellen maken met behulp van papier
- Wat is Aerobic vs. Anaerobic in Biology?
- Hoe water door planten beweegt
- Wetenschappers maken apparaat voor ultranauwkeurige genoomsequencing van afzonderlijke menselijke cellen
- Nieuwe vogelsoort genoemd naar Harvard-vader van biodiversiteit
- Oplossen van hoe een complexe ziekte eiken bedreigt
- Sterven mensen in politiehechtenis aan opgewonden delirium?
- Cilia: definitie, types en functie
- Diabetesmedicijn helpt bij het repareren van UV-beschadigd DNA in cellen van maankinderen
- Moscovium en Nihonium:FIONA meet het massagetal van twee superzware elementen

- Een scanning nearfield optische microscoop van het verstrooiingstype onderzoekt materialen op nanoschaal

- Weerstand is zinloos:supergeleiding zal het tijdperk van elektrisch vliegen inluiden

- Eerste beeldvorming van vrije nanodeeltjes in laboratoriumexperiment met behulp van een laserbron met hoge intensiteit
- ADMX-experiment legt 's werelds beste beperking op axions van donkere materie

 Nieuwe microscopietechniek onthult een functie die toepassingen van een klasse kwantummaterialen kan vormen
Nieuwe microscopietechniek onthult een functie die toepassingen van een klasse kwantummaterialen kan vormen De bosbrandencrisis trof 75% van de Australiërs:onderzoek
De bosbrandencrisis trof 75% van de Australiërs:onderzoek VS keuren Winklevoss dollar-gekoppelde cryptocurrencies goed
VS keuren Winklevoss dollar-gekoppelde cryptocurrencies goed Zuckerberg voert gesprekken in Washington over toekomstige regelgeving
Zuckerberg voert gesprekken in Washington over toekomstige regelgeving Nieuwe katalysator met dubbele functie voor waterstof- en plasticproductie
Nieuwe katalysator met dubbele functie voor waterstof- en plasticproductie Na jaren lang wachten, Israëli's aan boord van nieuwe snelle trein
Na jaren lang wachten, Israëli's aan boord van nieuwe snelle trein NASA analyseert nieuw gevormde tropische cycloon Cilidaa
NASA analyseert nieuw gevormde tropische cycloon Cilidaa Timber Wolf-aanpassingen
Timber Wolf-aanpassingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

