
Wetenschap
Is water een polair of niet -polair molecuul?
* ongelijke delen van elektronen: Het zuurstofatoom in water is meer elektronegatief dan de waterstofatomen. Dit betekent dat het de gedeelde elektronen in de covalente bindingen dichter bij zichzelf trekt, waardoor een gedeeltelijke negatieve lading (Δ-) op de zuurstof- en gedeeltelijke positieve ladingen (δ+) op de hydrogenen ontstaat.
* gebogen vorm: Het molecuul heeft een gebogen vorm, met de twee waterstofatomen onder een hoek naar het zuurstofatoom. Deze vorm voorkomt dat de kosten elkaar opzeggen, wat resulteert in een netto dipoolmoment.
Deze polariteit is cruciaal voor veel van de belangrijke eigenschappen van water, waaronder:
* Oplosbaarheid: Water is een goed oplosmiddel voor andere polaire moleculen zoals suikers en zouten.
* Hoog kookpunt: De sterke waterstofbindingen tussen watermoleculen vereisen veel energie om te breken, wat leidt tot een hoger kookpunt dan verwacht voor een molecuul van zijn grootte.
* Oppervlaktespanning: De aantrekkingskracht tussen watermoleculen aan het oppervlak creëert een sterke oppervlaktespanning.
* Biologisch belang: Met de polariteit van het water kan het deelnemen aan vele biologische processen, zoals het transport van voedingsstoffen en het reguleren van de temperatuur.
 Methode voor het maken van optisch actieve polymeren met behulp van een spiraalvormig vloeibaar-kristalsjabloon
Methode voor het maken van optisch actieve polymeren met behulp van een spiraalvormig vloeibaar-kristalsjabloon Tungsten als interstellaire stralingsafscherming?
Tungsten als interstellaire stralingsafscherming? Toont een molecuulformule de soorten en aantallen atomen die in de molecuulverbinding aanwezig zijn?
Toont een molecuulformule de soorten en aantallen atomen die in de molecuulverbinding aanwezig zijn?  Wat is bij benadering de pH van een oplossing waarin de concentratie trimethylamine 0,04 M en trimethylammoniumchloride 0,2 1. 9,2 2. 5,0 3. 7,5 4. 10,4 5. 3. is?
Wat is bij benadering de pH van een oplossing waarin de concentratie trimethylamine 0,04 M en trimethylammoniumchloride 0,2 1. 9,2 2. 5,0 3. 7,5 4. 10,4 5. 3. is?  Wat zijn 2 toepassingen voor metalen mineralen?
Wat zijn 2 toepassingen voor metalen mineralen?
 Alle organismen in een gebied inclusief niet -levende delen van hun omgeving?
Alle organismen in een gebied inclusief niet -levende delen van hun omgeving?  Hoeveel natuurlijke hulpbronnen biedt het milieu?
Hoeveel natuurlijke hulpbronnen biedt het milieu?  Waterstof is een van de toekomstige bestuurders van stookolie en milieuactivisten kunnen beide steunen
Waterstof is een van de toekomstige bestuurders van stookolie en milieuactivisten kunnen beide steunen Welk kenmerk zijn bezeten door levende dingen?
Welk kenmerk zijn bezeten door levende dingen?  Getijdevariatie van totale zwevende stoffen boven de Yangtze-bank
Getijdevariatie van totale zwevende stoffen boven de Yangtze-bank
Hoofdlijnen
- Welke organel van de cel en welke structuren die bevatten DNA?
- Twee uitzonderingen op de celtheorie identificeren?
- Onderzoek laat zien hoe genen de bladarchitectuur beïnvloeden
- Wat is het aantal organismen dat tot dezelfde biologische soorten behoort?
- Wat is een voorbeeld van een micro -organisme dat op schadelijke manier werkt?
- Wat is de definitie van wetenschappelijk woord erfelijkheid?
- Wat doet het mitochondrium?
- Wat zijn voorbeelden van symbiose -concurrentie en predatie in organismen?
- Wat zijn de definities van theorie -evolutie?
- Inktvis kan een milieuvriendelijk alternatief bieden voor plastic

- Om ingenieurs te verrassen, straling kan corrosie van sommige materialen vertragen
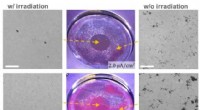
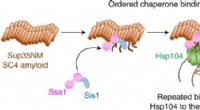
- Drie begeleiders coördineren het uiteenvallen van amyloïde fibrillen in gist
- Een stabiele koperkatalysator voor de omzetting van kooldioxide

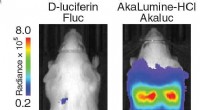
- In levende kleur:cellen van buiten het lichaam zien met synthetische bioluminescentie
 William Shatner wordt op 90-jarige leeftijd oudste astronaut:hoe ruimtetoerisme ouderen kan beïnvloeden
William Shatner wordt op 90-jarige leeftijd oudste astronaut:hoe ruimtetoerisme ouderen kan beïnvloeden Hoe produceert de zon energie en hoe wordt deze overgebracht naar de aarde?
Hoe produceert de zon energie en hoe wordt deze overgebracht naar de aarde?  Hoe helpen enzymen het organisme efficiënt gebruik te maken van hun energie?
Hoe helpen enzymen het organisme efficiënt gebruik te maken van hun energie?  Welk orgaan helpt de waterbalans te behouden en de pH gelijk te houden aan de zuurgraad?
Welk orgaan helpt de waterbalans te behouden en de pH gelijk te houden aan de zuurgraad?  Machine learning geïmplementeerd voor kwantumoptica
Machine learning geïmplementeerd voor kwantumoptica Welke warmteoverdracht maakt gebruik van elektromagnetische golven om de thermische energie te vergroten?
Welke warmteoverdracht maakt gebruik van elektromagnetische golven om de thermische energie te vergroten?  Wat is de goede geleider van warmte en elektriciteit?
Wat is de goede geleider van warmte en elektriciteit?  Toen twee ecosystemen met elkaar in botsing kwamen, ontwikkelden ichthyosaurussen het vermogen om grote prooien te consumeren opnieuw
Toen twee ecosystemen met elkaar in botsing kwamen, ontwikkelden ichthyosaurussen het vermogen om grote prooien te consumeren opnieuw
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

