
Wetenschap
Wat is een atoombinding?
Soorten atomaire bindingen:
* ionische bindingen: Deze bindingen vormen zich tussen atomen die een groot verschil hebben in elektronegativiteit (hun vermogen om elektronen aan te trekken). Het ene atoom verliest elektronen (een positief geladen ion worden) en het andere atoom krijgt elektronen (wordt een negatief geladen ion). De tegenovergestelde ladingen trekken aan en vormen een sterke elektrostatische binding. Voorbeelden:NaCl (tafelzout), MGO (magnesiumoxide).
* Covalente bindingen: Deze bindingen vormen zich wanneer atomen elektronen delen om een stabiele elektronenconfiguratie te bereiken. De gedeelde elektronen worden aangetrokken tot de kernen van beide atomen en houden ze bij elkaar. Covalente bindingen kunnen polair zijn (ongelijke delen van elektronen, waardoor een licht positief en negatief uiteinde ontstaat) of niet -polair (gelijk delen van elektronen). Voorbeelden:H2O (water), CO2 (koolstofdioxide), methaan (CH4).
* metalen bindingen: Deze bindingen treden op tussen metaalatomen. De valentie -elektronen zijn gedelocaliseerd, wat betekent dat ze niet aan een specifiek atoom zijn bevestigd en vrij door de metalen structuur kunnen bewegen. Deze "zee van elektronen" creëert sterke attracties tussen de positieve metaalionen, wat resulteert in een sterk en kneedbaar materiaal. Voorbeelden:koper (Cu), ijzer (Fe), goud (au).
Belangrijke kenmerken van atomaire bindingen:
* energie: Het vormen van bindingen brengt energie vrij, terwijl het verbreken van bindingen energie vereist. Dit is de reden waarom chemische reacties energieveranderingen inhouden.
* Kracht: De sterkte van een binding hangt af van het type binding en de betrokken atomen. Ionische bindingen zijn over het algemeen sterker dan covalente bindingen, die over het algemeen sterker zijn dan metaalbindingen.
* Directionaliteit: Sommige bindingen zijn directioneel (covalente bindingen), wat betekent dat ze in specifieke richtingen wijzen. Anderen (metalen bindingen) zijn niet-directioneel.
Waarom zijn atomaire bindingen belangrijk?
Atomische bindingen zijn cruciaal voor begrip:
* De eigenschappen van materie: Het type binding bepaalt de fysische en chemische eigenschappen van een stof (bijv. Smeltpunt, geleidbaarheid, reactiviteit).
* Chemische reacties: Chemische reacties omvatten het breken en de vorming van bindingen, wat leidt tot het creëren van nieuwe stoffen.
* De structuur van moleculen en materialen: Atomische bindingen bepalen hoe atomen zich rangschikken en moleculen en vaste structuren vormen.
Het begrijpen van atomaire bindingen is van fundamenteel belang voor de chemie en helpt ons het gedrag van alles uit te leggen, van eenvoudige moleculen tot complexe materialen.
 Op Kangaroo Island en elders, pas op voor de verleiding van de luxe ecotoerist
Op Kangaroo Island en elders, pas op voor de verleiding van de luxe ecotoerist Waarom is Ghana dit jaar zo heet? Een deskundige legt het uit
Waarom is Ghana dit jaar zo heet? Een deskundige legt het uit  Wildvuuras kan kwik vasthouden
Wildvuuras kan kwik vasthouden Chemie van zeespraydeeltjes voor het eerst gekoppeld aan vormingsproces
Chemie van zeespraydeeltjes voor het eerst gekoppeld aan vormingsproces Waarom zou een pinniped in staat zijn om verder in water te reizen dan op het land?
Waarom zou een pinniped in staat zijn om verder in water te reizen dan op het land?
Hoofdlijnen
- Wat voor soort micro-organisme kan ons ziek maken?
- In welke relatie profiteren beide soorten?
- Wat is gedrag van dieren gedragsaanpassing?
- Hoe wordt een cel genaamd die kan bestaan in een breed scala van omgevingscondities zich snel vermenigvuldigen en geen kern hebben?
- Wat voert dezelfde functie uit als ribosomen?
- Hoe virussen werken
- Wat gebruiken wetenschappers om dingen te vertegenwoordigen die ze niet direct kunnen bestuderen?
- Drie manieren waarop ziekteverwekkers het lichaam kunnen betreden?
- Sterfgevallen onder dinosauriërs uitbesteed aan India?
- Inerte stikstof gedwongen om met zichzelf te reageren
- Onderzoekers die een instrument ontwerpen om uranium te identificeren, atomen tegelijk

- Meervoudige aanval van virussen op bacteriën wijst op nieuwe manieren om infecties te bestrijden
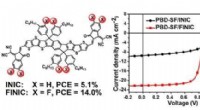
- Onderzoekers ontwikkelen elektronenacceptor met gefuseerde ring met 3D-exciton en ladingstransport
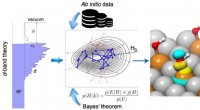
- De geheimen van chemische binding ontrafelen met machine learning
 Waarom vervalt El Niño sneller dan La Niña?
Waarom vervalt El Niño sneller dan La Niña? Gebruiken alle vormen van leven aminozuren in DNA om genetische informatie op te slaan?
Gebruiken alle vormen van leven aminozuren in DNA om genetische informatie op te slaan?  Wat studeren milieuwetenschappers?
Wat studeren milieuwetenschappers?  Spaanse eilandbewoners worstelen een jaar na vulkaanuitbarsting
Spaanse eilandbewoners worstelen een jaar na vulkaanuitbarsting Waarom zijn knoppen aan het einde van een tak?
Waarom zijn knoppen aan het einde van een tak?  Welke elementen hebben de kleinste atoomstraal broom, zwavel, chloor of selenium?
Welke elementen hebben de kleinste atoomstraal broom, zwavel, chloor of selenium?  Eerstelijnswetenschapslessenplannen op dieren
Eerstelijnswetenschapslessenplannen op dieren Waar zijn systemen van gemaakt in het menselijk lichaam?
Waar zijn systemen van gemaakt in het menselijk lichaam?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

