
Wetenschap
Wat gebeurt er als veel watermoleculen met elkaar in contact komen, verklaren?
1. Waterstofbinding:
* Watermoleculen zijn polair, wat betekent dat ze een enigszins positief uiteinde hebben (nabij de waterstofatomen) en een enigszins negatief uiteinde (nabij het zuurstofatoom).
* Met deze polariteit kunnen watermoleculen waterstofbruggen vormen, een type zwakke aantrekkingskracht tussen het positief geladen waterstofatoom van het ene molecuul en het negatief geladen zuurstofatoom van een ander.
* Deze waterstofbindingen vormen en breken voortdurend, waardoor water de vloeibaarheid ervan krijgt.
2. Cohesie en hechting:
* cohesie is de aantrekkingskracht tussenachtige moleculen. Watermoleculen zijn zeer samenhangend als gevolg van waterstofbinding, waardoor ze sterk aan elkaar blijven hangen. Dit draagt bij aan oppervlaktespanning, waardoor insecten op water kunnen lopen.
* hechting is de aantrekkingskracht tussen anders dan moleculen. Watermoleculen worden ook aangetrokken door andere polaire moleculen, zoals die in glas- of plantencelwanden. Hierdoor kan water smalle buizen omhoog klimmen, zoals in het xyleem van een plant, een fenomeen dat bekend staat als capillaire actie.
3. Hoge specifieke warmte:
* De waterstofbindingen in water vereisen veel energie om te breken. Dit betekent dat water een hoge specifieke warmtecapaciteit heeft, wat betekent dat er veel energie voor nodig is om zijn temperatuur te verhogen. Deze eigenschap helpt de temperatuur van de aarde te reguleren en houdt aquatische omgevingen stabiel.
4. Hoge verdampingswarmte:
* Om van een vloeistof naar een gas te veranderen, moeten watermoleculen de waterstofbindingen breken die ze bij elkaar houden. Dit vereist veel energie, daarom heeft water een hoge verdampingswarmte. Daarom helpt zweten ons af te koelen, omdat de verdamping van zweet warmte van het lichaam wegneemt.
5. Dichtheid Anomalie:
* Water is ongebruikelijk omdat het dichtst is bij 4 ° C. Terwijl water onder dit punt afkoelt, neemt de dichtheid af. Dit komt door de manier waarop waterstofbindingen zich bij lagere temperaturen rangschikken, waardoor een meer open structuur ontstaat. Met deze eigenschap kan ijs drijven, waardoor meren niet vast kunnen bevriezen en het waterleven kunnen overleven.
Samenvattend:
Wanneer watermoleculen in contact komen, vormen ze waterstofbruggen, wat leidt tot cohesie, hechting, hoge specifieke warmte, hoge verdampingswarmte en een dichtheidsafwijking. Deze eigenschappen maken water een essentiële substantie voor het leven op aarde, ter ondersteuning van talloze biologische en omgevingsprocessen.
 Storm Ciara zaait spoor van vernieling in heel Europa (update)
Storm Ciara zaait spoor van vernieling in heel Europa (update) Forest Service-wetenschap verbetert de voorspelling van brandweer
Forest Service-wetenschap verbetert de voorspelling van brandweer Welke eigenschappen maken water belangrijk voor levende wezens?
Welke eigenschappen maken water belangrijk voor levende wezens?  De ethische goudkoorts:vergulde leeftijd voor schuldvrije sieraden
De ethische goudkoorts:vergulde leeftijd voor schuldvrije sieraden Hoe is de natuurlijke vegetatie in Lincolnshire?
Hoe is de natuurlijke vegetatie in Lincolnshire?
Hoofdlijnen
- Waarom beschouw je de celtheorie als een theorie?
- Welke rollen spelen eiwitten in organismen?
- Waarom zijn er zoveel verschillende soorten organellen in eukaryotische cellen?
- Waar kan de brief e worden afgekort in ATP aan ADP?
- Wat hebben de processen van fotosynthese en celademhaling gemeen?
- Welke lichaamscellen hebben normaal gesproken geen kern?
- Uit onderzoek blijkt hoe de adelborstvis zijn urenlange paringsroep volhoudt
- Waarom de verkeerde etikettering van de mondiale Rode Lijst een risico vormt voor veel soorten
- Welk lichaamssysteem verwijdert cellulaire en vloeistofafval?
- Een proefschrift bracht nieuwe hi-precisie massametingen voor atomaire massa's van isotopen zwaarder dan ijzer

- Een onderzoeksteam ontwikkelt biotransistoren die de kleinste signalen kunnen detecteren

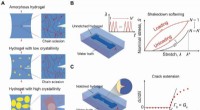
- Hydrogels tegen vermoeidheid en breuken
- Maskers slimmer en veiliger maken tegen COVID-19
- Onderzoekers gebruiken neurale netwerken voor geurherkenning

 Wat is dode cel?
Wat is dode cel?  Wat bevindt zich op 0 graden en waar de Equator Prime Meridian Cross?
Wat bevindt zich op 0 graden en waar de Equator Prime Meridian Cross?  Hoe goed kan informatie van het begin tot het einde der tijden worden opgeslagen?
Hoe goed kan informatie van het begin tot het einde der tijden worden opgeslagen?  Wat is de juiste definitie van Ecology Apex?
Wat is de juiste definitie van Ecology Apex?  Liften hoe werken
Liften hoe werken  Native Plants & Animals of China
Native Plants & Animals of China Hoe de pandemie het milieuveldonderzoek heeft beïnvloed
Hoe de pandemie het milieuveldonderzoek heeft beïnvloed Wat zijn de kenmerken van Kingdom Plantae?
Wat zijn de kenmerken van Kingdom Plantae?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

