
Wetenschap
Waarom zijn niet -polaire moleculen niet oplosbaar in water?
Water:
* Polar: Watermoleculen hebben een gebogen vorm als gevolg van de ongelijke delen van elektronen tussen de zuurstof- en waterstofatomen. Dit creëert een gedeeltelijke negatieve lading op het zuurstofatoom en een gedeeltelijke positieve lading op de waterstofatomen, waardoor het molecuul polair is.
* Sterke waterstofbinding: Watermoleculen vormen sterke waterstofbruggen met elkaar, waardoor een samenhangend netwerk ontstaat.
Niet -polaire moleculen:
* nonpolar: Niet -polaire moleculen hebben gelijkmatig verdeelde elektronen, wat resulteert in geen algemene ladingscheiding. Ze missen de gedeeltelijke positieve en negatieve ladingen die worden gevonden in polaire moleculen.
* Zwakke intermoleculaire krachten: Niet -polaire moleculen interageren door zwakke krachten zoals dispersiekrachten in Londen, die veel zwakker zijn dan waterstofbindingen.
Waarom niet -polaire moleculen niet oplossen in water:
1. Gebrek aan aantrekkingskracht: Watermoleculen worden sterk tot elkaar aangetrokken via waterstofbruggen. Ze zijn niet in staat om significante aantrekkelijke interacties te vormen met niet -polaire moleculen, die de noodzakelijke gedeeltelijke ladingen voor waterstofbinding missen.
2. Energieboete: Om een niet -polair molecuul in water op te lossen, zouden waterstofbruggen tussen watermoleculen moeten worden verbroken, waardoor aanzienlijke energie nodig is. Dit proces is energetisch ongunstig.
3. "zoals oplost zoals": Het principe van "zoals oplost zoals" stelt dat stoffen met vergelijkbare intermoleculaire krachten de neiging hebben om in elkaar op te lossen. Omdat water zeer polaire is en niet -polaire moleculen zwakke intermoleculaire krachten hebben, zijn ze niet compatibel.
In wezen creëert de sterke polaire aard van water en het gebrek aan polariteit in niet -polaire moleculen een mismatch in intermoleculaire krachten. Dit maakt het energetisch ongunstig voor niet -polaire moleculen om op te lossen in water.
Voorbeeld: Olie is een niet -polaire stof en mengt zich niet met water. Wanneer u olie en water probeert te mengen, scheiden ze zich in verschillende lagen. Dit komt omdat de watermoleculen zich meer tot elkaar aangetrokken voelen dan tot de oliemoleculen.
 Wat betekent omnivore in de wetenschap?
Wat betekent omnivore in de wetenschap?  Hoe korrels van verschillende grootte worden beïnvloed door winderosie?
Hoe korrels van verschillende grootte worden beïnvloed door winderosie?  Stedelijke hitte-eilanden hebben invloed op de temperatuur en gezondheid van het bladerdak, studie zegt:
Stedelijke hitte-eilanden hebben invloed op de temperatuur en gezondheid van het bladerdak, studie zegt: Westerse bosbranden kalmeren bij koud weer, maar verliezen groeien
Westerse bosbranden kalmeren bij koud weer, maar verliezen groeien Tarieven en risico's voor het zaaien van sojabonen
Tarieven en risico's voor het zaaien van sojabonen
Hoofdlijnen
- Hoe weet je of je plant rasechte en hybride is?
- Welke componenten van een cel zijn uniek voor plantencellen?
- Wat is de rol van kern?
- Hoe nakomen genen het recessieve nakomelingen?
- Wat beschrijft sommige eiwitmoleculen het beste in een cel?
- Waar gaat deze altijd deel uit van de wetenschappelijke methode?
- Waarom zijn decomposers belangrijk in een ecosysteem?
- Wat wordt bedoeld met morfologische diversiteit?
- Welk jaar was het eerste DNA -model?
- 3D-geprinte potten in experimenten met kogelfrezen

- Onderzoekers creëren een 3D-geprinte slimme gel die onder water loopt, beweegt objecten

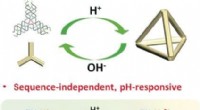
- Universele pH-gereguleerde assemblage van DNA-nanostructuren
- Lab creëert stoere, maar teder, kankerbestrijders
- Steenkool onthult een verfijnde kant:vuile koolstof kan worden gebruikt om een verscheidenheid aan nuttige apparaten te maken

 Wat is de relatie tussen meeteenheden voor het volume van een vloeistof en een vaste vloeistof?
Wat is de relatie tussen meeteenheden voor het volume van een vloeistof en een vaste vloeistof?  Waarom houdt de kachel het huis niet warm?
Waarom houdt de kachel het huis niet warm?  Wordt de hoeveelheid elektriciteit in een plafondventilator met licht groter wanneer beide functies worden gebruikt?
Wordt de hoeveelheid elektriciteit in een plafondventilator met licht groter wanneer beide functies worden gebruikt?  Is het oplossen van ammoniumchloride in water een chemische verandering?
Is het oplossen van ammoniumchloride in water een chemische verandering?  Het geheim van Rembrandts impasto onthuld
Het geheim van Rembrandts impasto onthuld Welk type energie is gerelateerd aan de massa en snelheid van een object?
Welk type energie is gerelateerd aan de massa en snelheid van een object?  Goud uit rotsen smelten
Goud uit rotsen smelten Wat heeft de zijkant van de aarde tegenover de zon?
Wat heeft de zijkant van de aarde tegenover de zon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

