
Wetenschap
De afnemende volgorde voor de relatieve sterkten van chemische bindingen?
sterkste tot zwakste:
1. Covalente bindingen: Deze omvatten het delen van elektronen tussen atomen. Ze zijn het sterkste type binding en zijn verantwoordelijk voor het bij elkaar houden van de meeste moleculen.
* Voorbeelden: De bindingen in water (h₂o), methaan (ch₄) en diamant (c).
* factoren die de kracht beïnvloeden:
* Bond -bestelling: Meerdere obligaties (dubbele en drievoudige bindingen) zijn sterker dan enkele bindingen.
* elektronegativiteit: Bindingen tussen atomen met vergelijkbare elektronegativiteiten (neiging om elektronen aan te trekken) zijn sterker.
* Grootte van atomen: Kleinere atomen vormen sterkere covalente bindingen.
2. ionische bindingen: Deze omvatten de elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen (atomen die elektronen hebben gewonnen of verloren).
* Voorbeelden: Natriumchloride (NaCl), kaliumbromide (KBR) en magnesiumoxide (MGO).
* factoren die de kracht beïnvloeden:
* lading van ionen: Hogere ladingen leiden tot sterkere ionische bindingen.
* Afstand tussen ionen: Kleinere ionen en nauwere nabijheid resulteren in sterkere bindingen.
3. metalen bindingen: Deze komen voor in metalen en omvatten het delen van gedelokaliseerde elektronen met een rooster van positief geladen metaalionen. Ze zijn verantwoordelijk voor de karakteristieke eigenschappen van metalen, zoals goede geleidbaarheid.
* Voorbeelden: Koper (Cu), goud (AU), ijzer (Fe).
* factoren die de kracht beïnvloeden:
* Aantal valentie -elektronen: Meer valentie -elektronen beschikbaar voor delocalisatie leiden tot sterkere bindingen.
* Grootte van atomen: Kleinere atomen met een hogere dichtheid van valentie -elektronen leiden tot sterkere metalen bindingen.
4. Waterstofbindingen: Dit zijn speciale dipool-dipoolinteracties waarbij een waterstofatoom betrokken is gebonden aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor). Ze zijn relatief zwak maar belangrijk in veel biologische systemen.
* Voorbeelden: Water (H₂O) Moleculen, DNA -structuur.
* factoren die de kracht beïnvloeden:
* elektronegativiteit: Hogere elektronegativiteit van het aan waterstof gebonden atoom resulteert in sterkere waterstofbruggen.
5. Van der Waals krachten: Dit zijn de zwakste intermoleculaire krachten. Ze komen voort uit tijdelijke schommelingen in elektronenverdeling, wat leidt tot tijdelijke dipolen.
* typen: Londense dispersiekrachten, dipool-dipool interacties.
* Voorbeelden: Tijdelijke attracties tussen edelgasatomen, interacties tussen niet -polaire moleculen.
Sleutelpunten:
* Deze bestelling is een generalisatie. De sterkte van een bepaalde binding hangt af van de specifieke betrokken atomen en de omstandigheden om hen heen.
* De relatieve sterke punten van verschillende soorten chemische bindingen kunnen een significante impact hebben op de fysische en chemische eigenschappen van stoffen.
Laat het me weten als je meer details wilt over een specifiek type binding!
 Nieuwe technologie voor de productie van vliegtuigstructuren heeft hun kracht vergroot
Nieuwe technologie voor de productie van vliegtuigstructuren heeft hun kracht vergroot Wat is er gebeurd met deeltjes van een stof naarmate de temperatuur toeneemt?
Wat is er gebeurd met deeltjes van een stof naarmate de temperatuur toeneemt?  Wat is het percentage samenstelling van chroom in BACRO4?
Wat is het percentage samenstelling van chroom in BACRO4?  Welk element heeft een atoommassa van 83.3?
Welk element heeft een atoommassa van 83.3?  Nieuw elektrodemateriaal ontwikkeld om de laadcapaciteit van lithiumbatterijen te vergroten
Nieuw elektrodemateriaal ontwikkeld om de laadcapaciteit van lithiumbatterijen te vergroten
 Van luxe hotels tot sloppenwijken, Haïti maakt goed gebruik van gebruikte zeep
Van luxe hotels tot sloppenwijken, Haïti maakt goed gebruik van gebruikte zeep Van sterrenstof tot lichtblauwe stip:interstellaire reis van koolstof naar de aarde
Van sterrenstof tot lichtblauwe stip:interstellaire reis van koolstof naar de aarde Sommige stormachtige Floridians halen hun schouders op, anderen vluchten of bunkeren
Sommige stormachtige Floridians halen hun schouders op, anderen vluchten of bunkeren Rapport koppelt 's werelds grootste vleesbedrijf aan ontbossing
Rapport koppelt 's werelds grootste vleesbedrijf aan ontbossing Het onrecht dat onderwijs het milieu aandoet:een verhaal van een overlevende
Het onrecht dat onderwijs het milieu aandoet:een verhaal van een overlevende
Hoofdlijnen
- Waarom gebaren we?
- Wat betekent synostologie?
- Wat is het deel van plantencel dat instructie bevat voor Called?
- Onderzoek identificeert transformatieve leerervaringen van veldcursussen
- Hoe wetenschappers DNA-codes herontwerpen
- MRNA STRAND wordt gemaakt in het proces van wat?
- Hoe kruipen mieren op muren? Een bioloog legt hun kleverige, stekelige, zwaartekracht tartende greep uit
- Welke structuur maakt bloedcellen en zorgen voor spieren om te hechten?
- Mensen en gorilla's hebben één ander aminozuur in hun hemoglobine -sequentie. Wat zegt dit over de evolutie van deze twee soorten?
- Wetenschappers ontwikkelen goedkope chip om aanwezigheid en hoeveelheid COVID-19-antilichamen te detecteren

- Osmium-activering in kankercellen

- Middeleeuwse kruitrecepten opblazen

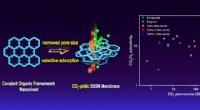
- Eenfasige covalente organische raamwerkmembranen maken CO2-selectieve scheiding mogelijk
- Licht van zeldzame aarde:nieuwe kansen voor organische light-emitting diodes
 Hoe definieer je biotechnologie?
Hoe definieer je biotechnologie?  Hoe kunnen polymeren worden gebruikt in optische materialen?
Hoe kunnen polymeren worden gebruikt in optische materialen?  Wat is het verschil tussen een 5-punts ster en een ruimte in de ruimte?
Wat is het verschil tussen een 5-punts ster en een ruimte in de ruimte?  Inside job:een nieuwe techniek om een fusiereactor te koelen
Inside job:een nieuwe techniek om een fusiereactor te koelen Verlaagt koorts de metabole lichaamssnelheid om energie te besparen?
Verlaagt koorts de metabole lichaamssnelheid om energie te besparen?  Hoeveel atomen zijn aanwezig in CA HCO3 2?
Hoeveel atomen zijn aanwezig in CA HCO3 2?  Wiskundig model voorspelt de beweging van microplastics in de oceaan
Wiskundig model voorspelt de beweging van microplastics in de oceaan Wat is ecologische zonde?
Wat is ecologische zonde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

