
Wetenschap
Hoeveel kJ energie wordt vrijgegeven wanneer de bindingen in twee mol watermoleculen worden gevormd?
Inzicht in het concept
* Vorming van bindingen is exotherme: Wanneer chemische bindingen zich vormen, wordt energie vrijgegeven. Dit komt omdat de atomen in de bindingen zich in een lagere energietoestand bevinden dan wanneer ze gescheiden zijn.
* Bond -energie: De energie die nodig is om een specifieke binding of de vrijgegeven energie te verbreken wanneer een binding wordt gevormd, wordt de bindingsenergie genoemd.
Berekeningen
1. Identificeer de bindingen: Water (H₂o) heeft twee O-H-bindingen.
2. Vind de bindingsenergie: De gemiddelde bindingsenergie voor een O-H-binding is ongeveer 463 kJ/mol.
3. Bereken voor twee mol:
* Energie per watermolecuul:2 * 463 kJ/mol =926 kJ/mol
* Energie voor twee mol:926 kJ/mol * 2 mol = 1852 kJ
Daarom zal ongeveer 1852 kJ energie worden vrijgegeven wanneer de bindingen in twee mol watermoleculen worden gevormd.
 Verkeerde migraties zorgen ervoor dat schelpdieren niet kunnen ontsnappen aan de opwarming van de oceaan
Verkeerde migraties zorgen ervoor dat schelpdieren niet kunnen ontsnappen aan de opwarming van de oceaan Watertekorten in het westen van de VS waarschijnlijker dan eerder werd gedacht
Watertekorten in het westen van de VS waarschijnlijker dan eerder werd gedacht Het ontrafelen van de mysteries van opeenvolgende atmosferische riviergebeurtenissen
Het ontrafelen van de mysteries van opeenvolgende atmosferische riviergebeurtenissen  Hoe weer en klimaat het levensondersteunende oppervlak van de aarde vormen
Hoe weer en klimaat het levensondersteunende oppervlak van de aarde vormen Klimaatverandering vormt een onzekere toekomst voor de aquatische habitats van Indianas
Klimaatverandering vormt een onzekere toekomst voor de aquatische habitats van Indianas
Hoofdlijnen
- Wat onderscheidt mensen van chimpansees en andere apen? | Hoe dingen werken
- Welke organel combineert eiwitten?
- Wat is de margays -fysiologie?
- Waarom zijn elektronenmicroscoop een voordeel bij het bestuderen van cellen?
- Met welk proces kan een enkele cellen zygote zich ontwikkelen tot meercellulair organisme?
- Onderzoekers bewerken genen om COVID-19 te voorkomen en te behandelen in het laboratorium. Werkt het bij mensen?
- Anaërobe katabolisme van organische voedingsstoffen wordt genoemd?
- Hoe komt de groei van een organisme voor?
- Actine-onderzoek laat zien hoe vlindervleugels hun levendige kleuren krijgen
- Het meten van ethanol dodelijke tweeling

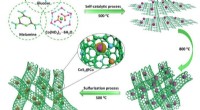
- S, N co-gedoteerde koolstof nanobuis ingekapselde CoS2@Co
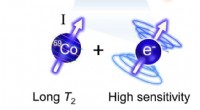
- Chemici ontwerpen chemische sonde voor het detecteren van minieme temperatuurverschuivingen in het lichaam
- Onderzoekers ontwikkelen 3D-printsubstraat met dynamische bindingen voor instelbare eigenschappen

- Beeldtechnologieën verhogen de focus op plaats delict

 Hoe potentiële energie komt voor?
Hoe potentiële energie komt voor?  Hoeveel mm zijn gelijk aan 35 L?
Hoeveel mm zijn gelijk aan 35 L?  Wat is het verschil tussen diabaas en dioriet?
Wat is het verschil tussen diabaas en dioriet?  Bergen beïnvloeden de impact van aardbevingen
Bergen beïnvloeden de impact van aardbevingen Hoe beweegt de vloeistof in een thermometer op en neer?
Hoe beweegt de vloeistof in een thermometer op en neer?  Opwarming van de markt voor elektrische voertuigen
Opwarming van de markt voor elektrische voertuigen Waarom is het op zonne -energie moeilijk te benutten?
Waarom is het op zonne -energie moeilijk te benutten?  Wat is de plaat van aardkorst die regelmatig weggaat van of botst met andere platen die worden genoemd?
Wat is de plaat van aardkorst die regelmatig weggaat van of botst met andere platen die worden genoemd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

