
Wetenschap
Wat is het gedrag van deeltjes in gas?
Het gedrag van deeltjes in een gas:een wervelwindtour
Deeltjes in een gas zijn constant, willekeurige beweging . Ze bewegen met hoge snelheden en in alle richtingen, botsen tegen elkaar en de wanden van hun container. Hier is een uitsplitsing van belangrijke kenmerken:
1. Constante, willekeurige beweging:
* Gasdeeltjes blijven niet op één plek. Ze bewegen vrij, botsen met elkaar en stuiteren in willekeurige richtingen.
* Deze willekeurige beweging is waarom gassen elke container kunnen vullen die ze bezetten.
2. Hoge snelheid en kinetische energie:
* Gasdeeltjes bewegen bij hoge snelheden, vooral bij hogere temperaturen.
* Deze snelheid vertaalt zich in significante kinetische energie, wat de energie van beweging is.
3. Zwakke intermoleculaire krachten:
* In vergelijking met vloeistoffen en vaste stoffen ervaren gasdeeltjes zwakke intermoleculaire krachten. Deze krachten houden deeltjes bij elkaar, maar worden gemakkelijk overwonnen door de hoge kinetische energie van de deeltjes.
* Dit verklaart waarom gassen kunnen uitbreiden om een container te vullen.
4. Grote interdeeltjesafstand:
* Gasdeeltjes liggen ver uit elkaar in vergelijking met vloeistoffen en vaste stoffen.
* Deze grote afstand tussen deeltjes draagt bij aan de samendrukbaarheid van gassen.
5. Samperrukbaarheid:
* Vanwege de grote interdeeltjesafstand kunnen gasdeeltjes samen worden geperst.
* Dit betekent dat gassen kunnen worden gecomprimeerd in kleinere volumes, in tegenstelling tot vaste stoffen en vloeistoffen.
6. Diffusie:
* Gasdeeltjes mengen constant met elkaar vanwege hun willekeurige beweging.
* Dit proces, diffusie genoemd, gebeurt omdat deeltjes van gebieden met een hogere concentratie naar gebieden met een lagere concentratie overgaan.
7. Effusie:
* Gasdeeltjes kunnen ontsnappen door kleine openingen.
* Dit proces, effusie genoemd, is gerelateerd aan de snelheid van gasdeeltjes en de grootte van de opening.
8. Druk:
* De constante beweging van gasdeeltjes resulteert in botsingen met de wanden van hun container.
* De kracht van deze botsingen creëert druk, wat de kracht is per eenheidsgebied.
Key Takeaway: Gasdeeltjes gedragen zich anders dan deeltjes in vloeistoffen of vaste stoffen. Ze hebben hoge kinetische energie, zwakke intermoleculaire krachten en grote interparticle -afstanden. Dit leidt tot unieke kenmerken zoals samendrukbaarheid, diffusie en effusie.
 Hoeveel natriumnitraat wordt geproduceerd als 1,7 g zilver en 1,5 g jodide reageren?
Hoeveel natriumnitraat wordt geproduceerd als 1,7 g zilver en 1,5 g jodide reageren?  Wat is de chemische stof tegenover zuur?
Wat is de chemische stof tegenover zuur?  Is helium een element of molicles?
Is helium een element of molicles?  Gelijktijdige meting van biofysische eigenschappen en positie van afzonderlijke cellen in een microdevice
Gelijktijdige meting van biofysische eigenschappen en positie van afzonderlijke cellen in een microdevice Wat zijn de kenmerken van semi-metalen?
Wat zijn de kenmerken van semi-metalen?
 Landslakkenhuizen helpen bij het reconstrueren van kwantitatieve temperatuur
Landslakkenhuizen helpen bij het reconstrueren van kwantitatieve temperatuur Milieuproblemen in El Paso
Milieuproblemen in El Paso Nieuwe publicatie onderzoekt gevolgen van grondwateruitputting voor de landbouw
Nieuwe publicatie onderzoekt gevolgen van grondwateruitputting voor de landbouw 5 dingen die Joe Biden kan doen om klimaatverandering te bestrijden - zonder hulp van het Congres
5 dingen die Joe Biden kan doen om klimaatverandering te bestrijden - zonder hulp van het Congres Waarom probeert u binnen de wetenschap niet super-natuurlijke fenomenen uit te leggen?
Waarom probeert u binnen de wetenschap niet super-natuurlijke fenomenen uit te leggen?
Hoofdlijnen
- Wat zijn de kenmerken van DNA?
- Is een obligate halofiel organisme dat een hoge osmotische druk vereist?
- Elektronenmicroscoopbeelden laten zien hoe cellen een vitaal mineraal opnemen
- Vang me als je kunt:hoe mRNA-therapieën in cellen worden afgeleverd
- Waarom wordt cellulaire ademhaling aerobe proces genoemd?
- Waarom is de bevolking de kleinste eenheid van het organisme dat kan evolueren?
- Welke ziekte omvat de afbraak van luchtzakken?
- Waar zou mitochondria zijn ontstaan?
- Welke voordelen heeft biologische landbouw voor de honingbijen?
- Een venster voor traploos ladingtransport in organische halfgeleiders
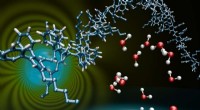
- Een nieuwe methode om zwavel in complexe moleculen te installeren

- Verrassende antibacteriële activiteit en selectiviteit van hydrofiele fosfoniumpolymeren
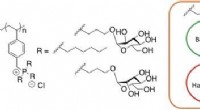
- Plastic transparanter maken en tegelijkertijd elektrische geleidbaarheid toevoegen

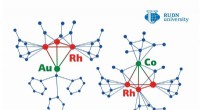
- Chemici suggereren een methode voor het produceren van op metaal gebaseerde katalysatoren met een ongeëvenaarde efficiëntie
 Ecologische voetafdruk en ecosysteemdiensten Hoe verhouden ze zich tot milieuburgerschap?
Ecologische voetafdruk en ecosysteemdiensten Hoe verhouden ze zich tot milieuburgerschap?  Wat zijn de takken van de wetenschap?
Wat zijn de takken van de wetenschap?  Welke naam wordt gegeven aan culturen voor het identificeren van organismen en de antibiotica van de gevoeligheden organisme?
Welke naam wordt gegeven aan culturen voor het identificeren van organismen en de antibiotica van de gevoeligheden organisme?  Waarom ‘barsten’ sterrenstelsels? ALMA ziet superstellaire kraamkamers in het hart van het beeldhouwerstelsel
Waarom ‘barsten’ sterrenstelsels? ALMA ziet superstellaire kraamkamers in het hart van het beeldhouwerstelsel  Wat zijn de belangrijke voordelen van wetenschap en technologie?
Wat zijn de belangrijke voordelen van wetenschap en technologie?  Hoe de aarde werd bewaterd
Hoe de aarde werd bewaterd  Welke delen zijn hetzelfde in alle nucleotiden en anders?
Welke delen zijn hetzelfde in alle nucleotiden en anders?  Facebook vraagt patent aan op technologie waarmee huishoudens kunnen worden gekoppeld voor gerichte advertenties
Facebook vraagt patent aan op technologie waarmee huishoudens kunnen worden gekoppeld voor gerichte advertenties
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

