
Wetenschap
Waarom breiden gassen het meest uit op verwarming en vaste stoffen?
1. Intermoleculaire krachten:
* gassen: Gasmoleculen liggen erg ver uit elkaar, met zeer zwakke intermoleculaire krachten. Ze bewegen vrij en willekeurig. Wanneer verhit, neemt de kinetische energie van de moleculen aanzienlijk toe, waardoor ze sneller bewegen en verder verspreiden. Dit leidt tot een grote expansie in volume.
* vloeistoffen: Vloeibare moleculen zijn dichter bij elkaar dan gasmoleculen, met sterkere intermoleculaire krachten. Ze kunnen nog steeds bewegen, maar hun beweging is beperkt. Verwarming verhoogt hun kinetische energie, waardoor ze sneller bewegen en een beetje verspreiden, maar de sterkere krachten beperken de expansie in vergelijking met gassen.
* vaste stoffen: Vaste stoffen hebben de sterkste intermoleculaire krachten en houden moleculen in een vaste, rigide structuur. Hoewel verwarming de trillingen van moleculen binnen deze structuur verhoogt, voorkomen de sterke krachten dat ze ver uit elkaar gaan. Aldus breiden vaste stoffen het minst uit wanneer het wordt verwarmd.
2. Dichtheid:
* gassen: Gassen hebben de laagste dichtheid omdat hun moleculen ver uit elkaar liggen. Dit betekent dat er meer ruimte is voor de moleculen om zich te verspreiden wanneer ze worden verwarmd.
* vloeistoffen: Vloeistoffen hebben een hogere dichtheid dan gassen. Dit beperkt de uitbreiding omdat de moleculen minder ruimte hebben om te bewegen.
* vaste stoffen: Vaste stoffen hebben de hoogste dichtheid, wat betekent dat hun moleculen strak zijn verpakt. Dit laat weinig ruimte voor uitbreiding wanneer verwarmd.
3. Thermische expansiecoëfficiënt:
De thermische expansiecoëfficiënt is een materiaaleigenschap die kwantificeert hoeveel een materiaal uitzet voor een bepaalde temperatuurstijging. Gassen hebben de hoogste coëfficiënt, gevolgd door vloeistoffen en vaste stoffen hebben het laagste.
Samenvattend:
Het verschil in expansie is direct gerelateerd aan de vrijheid van beweging van moleculen binnen elke toestand van materie. Hoe zwakker de intermoleculaire krachten en hoe lager de dichtheid, hoe groter de expansie bij verwarming.
 Welke menselijke acties bedreigen het voortbestaan van bossen?
Welke menselijke acties bedreigen het voortbestaan van bossen?  Wat kan een graslandecosysteem meer herbivoren ondersteunen dan het bosecosysteem?
Wat kan een graslandecosysteem meer herbivoren ondersteunen dan het bosecosysteem?  Door de mens veroorzaakte klimaatverandering speelde een beperkte rol in de airpocalypse van Peking in 2013
Door de mens veroorzaakte klimaatverandering speelde een beperkte rol in de airpocalypse van Peking in 2013 Vulkanische groei cruciaal voor de vorming van Panama
Vulkanische groei cruciaal voor de vorming van Panama Behoud voldoet aan plan om 80% van Amazon te beschermen
Behoud voldoet aan plan om 80% van Amazon te beschermen
Hoofdlijnen
- Informatie stelen van waardplanten:hoe de parasitaire dodderplant bloeit
- Hoe evolutie de geometrieën van het leven vormgeeft:wetenschappers lossen een al lang bestaande biologische puzzel op
- Wat is hypogeale kieming?
- Wat is evolutiedefinitie?
- Hoeveel genen worden in de hoogte van de mens uitgenomen?
- Weet je iets over wetenschap?
- Walviskarkas opgegraven van Australisch strand vanwege angst voor haaien
- Onderzoekers ontdekken hoe gelei-zeedieren moderne robotica kunnen vormen
- Hoe herstelt de huid?
- Nieuw biokatalytisch membraan verwijdert microverontreinigingen op een efficiënte en stabiele manier

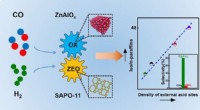
- Directe synthese van isoparaffinerijke benzine uit syngas
- Nog twee polymorfen gevonden voor rood-oranje-geel

- Onderzoekers gebruiken microgolven om tekenen van uitdroging te meten

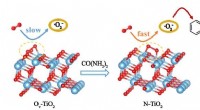
- Onderzoek naar zeer selectieve katalysatoren via fabricage van zuurstofvacatures op TiO2
 Structuur van gesteenten uit fossiele brandstoffen is eindelijk gedecodeerd
Structuur van gesteenten uit fossiele brandstoffen is eindelijk gedecodeerd Wat kan er worden gevormd uit mineraal?
Wat kan er worden gevormd uit mineraal?  Welke component wordt verminderd tijdens de elektrolyse van pekel?
Welke component wordt verminderd tijdens de elektrolyse van pekel?  Babybonussen en trouwklokken:hoe de grote momenten in het leven startups kunnen uitdagen
Babybonussen en trouwklokken:hoe de grote momenten in het leven startups kunnen uitdagen  Wanneer eerlijkheid zegeviert:onderzoek laat zien hoe onzekerheid gedrag beïnvloedt
Wanneer eerlijkheid zegeviert:onderzoek laat zien hoe onzekerheid gedrag beïnvloedt  Doorspoelende toiletten creëren wolken van virusbevattende deeltjes
Doorspoelende toiletten creëren wolken van virusbevattende deeltjes Wat is een pakkende naam voor Science Fair -project die te maken heeft met radiogolven?
Wat is een pakkende naam voor Science Fair -project die te maken heeft met radiogolven?  Thermografie Voordelen & Nadelen
Thermografie Voordelen & Nadelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

