
Wetenschap
Leg uit waarom de specifieke waterwarmte hoger is dan de meeste andere stoffen specificeren?
1. Waterstofbinding:
- Watermoleculen zijn polair, met een positieve lading op het waterstofuiteinde en een negatieve lading op het zuurstofuiteinde. Hierdoor kunnen ze sterke waterstofbruggen met elkaar vormen.
- Deze waterstofbindingen vereisen een aanzienlijke hoeveelheid energie om te breken, daarom heeft water meer energie nodig om de temperatuur te verhogen in vergelijking met stoffen met zwakkere intermoleculaire krachten.
2. Moleculaire structuur:
- De gebogen vorm van het watermolecuul creëert een tetraëdrische opstelling van waterstofbruggen. Deze structuur zorgt voor een sterk netwerk van waterstofbindingen, waardoor de energie die nodig is om de opstelling te verstoren verder te vergroten.
3. Hoge diëlektrische constante:
- De hoge diëlektrische constante van het water betekent dat het elektrostatische interacties tussen moleculen effectief kan screenen, waardoor de stabiliteit van waterstofbruggen verder wordt verbeterd.
4. Vloeibare toestand:
- Terwijl andere stoffen sterke bindingen in hun vaste toestand kunnen hebben, bestaat water als een vloeistof over een breed temperatuurbereik. Dit betekent dat de waterstofbindingen constant vormen en breken, waardoor continue energie -input nodig is om de vloeibare toestand te behouden.
gevolgen van de hoge specifieke hitte van water:
* Temperatuurmoderatie: Grote waterlichamen absorberen een aanzienlijke hoeveelheid warmte zonder drastische temperatuurveranderingen, waardoor een cruciale rol wordt gespeeld bij het reguleren van de wereldwijde temperaturen.
* Klimaatregulering: Oceanen fungeren als koellichamen, absorberen warmte in de zomer en brengen het in de winter los, waardoor gematigde kustklimaten worden vrijgesproken.
* Biologisch belang: Hoge specifieke warmte helpt stabiele interne lichaamstemperaturen in levende organismen te behouden, waardoor drastische temperatuurschommelingen worden voorkomen.
Samenvattend is de hoge specifieke warmte van water voornamelijk te wijten aan de sterke waterstofbinding, moleculaire structuur en zijn vermogen om te bestaan als een vloeistof over een breed temperatuurbereik. Deze unieke eigenschap heeft diepgaande gevolgen voor het leven op aarde en het klimaat.
 Verbreken hoge temperaturen waterstofbruggen?
Verbreken hoge temperaturen waterstofbruggen?  Wat gebruiken wetenschappers om de kristalstructuur van mineraal te bestuderen?
Wat gebruiken wetenschappers om de kristalstructuur van mineraal te bestuderen?  Kunnen moleculen met moleculaire formules C4H10 en C4H10O isomeren van elkaar zijn waarom of waarom niet?
Kunnen moleculen met moleculaire formules C4H10 en C4H10O isomeren van elkaar zijn waarom of waarom niet?  Wat is een goede vergelijking van de lading een elektron en proton?
Wat is een goede vergelijking van de lading een elektron en proton?  Hoeveel massa heeft 1 mol zwavelatomen?
Hoeveel massa heeft 1 mol zwavelatomen?
 Hoe noem je het pad van de aarde als het draait om de zon?
Hoe noem je het pad van de aarde als het draait om de zon?  Rossby-golven beïnvloeden ons weer en getijden, maar wat zijn ze?
Rossby-golven beïnvloeden ons weer en getijden, maar wat zijn ze? Is de boom zijn hoofd naar de zonnepersonificatie verhoogd?
Is de boom zijn hoofd naar de zonnepersonificatie verhoogd?  Artsen waarschuwen voor gezondheidsnood als smog de hoofdstad van India bedekt
Artsen waarschuwen voor gezondheidsnood als smog de hoofdstad van India bedekt Klimaatvragen:wat zijn de oplossingen voor klimaatverandering?
Klimaatvragen:wat zijn de oplossingen voor klimaatverandering?
Hoofdlijnen
- Zeewier als biobrandstof? Metabolic engineering maakt het een haalbare optie
- Wat is oogenisis?
- Bevat de plantencel of dier genetisch materiaal?
- Genen wijzen op één grote Europese familie
- Hoe kunnen structuren met een cel gespecialiseerd worden?
- Wat is de naam van organel die betrokken is bij zuurstof die proces vereist door welke energie -macromoleculen ATP heeft opgeslagen?
- Herenbaarden dragen meer bacteriën dan hondenbont,
- Perfect bewaarde prehistorische leeuwenwelp gevonden in Russische permafrost
- Leg uit waarom grote actieve organismen een speciaal oppervlak nodig hebben voor uitwisseling?
- Nieuwe sonde voor stofwisselingsziekten
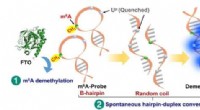
- Speekseltest voor cannabis kan ooit helpen bij het identificeren van gehandicapte bestuurders

- Energie op aanvraag:leren van katalysatoren uit de natuur
- Een katapult om drugs op de plaats van een infectie te schieten

- Stam gebruiken om oxynitride-eigenschappen te beheersen

 Archeologieteam ontdekt een 7000 jaar oude nederzetting in Servië
Archeologieteam ontdekt een 7000 jaar oude nederzetting in Servië  Autonome nanomachines geïnspireerd door de natuur
Autonome nanomachines geïnspireerd door de natuur Technieken voor het overslaan van stenen kunnen de terugkeer van ruimtevoertuigen verbeteren
Technieken voor het overslaan van stenen kunnen de terugkeer van ruimtevoertuigen verbeteren Op welke snelheid reist het ruimtestation?
Op welke snelheid reist het ruimtestation?  Hoe werkt elastische kracht?
Hoe werkt elastische kracht?  Wat is de levensduur van positroniumionen?
Wat is de levensduur van positroniumionen?  Hoe bereken je de ouder- en dochterisotopen om de fractie atomen te vinden die in een fossiel achterblijven?
Hoe bereken je de ouder- en dochterisotopen om de fractie atomen te vinden die in een fossiel achterblijven?  Hoeveel elektronen zijn er in 0,60 coulombs?
Hoeveel elektronen zijn er in 0,60 coulombs?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

