
Wetenschap
Waarom is de geleiding van het gas langzaam?
1. Lage dichtheid: Gasmoleculen liggen ver uit elkaar in vergelijking met vloeistoffen of vaste stoffen. Dit betekent dat er minder botsingen zijn tussen moleculen, die essentieel zijn voor het overbrengen van warmte -energie.
2. Zwakke intermoleculaire krachten: Gasmoleculen hebben zeer zwakke aantrekkelijke krachten tussen hen. Dit betekent dat ze minder geneigd zijn om kinetische energie te delen via botsingen.
3. Hoog gemiddeld gratis pad: Het gemiddelde vrije pad, of de gemiddelde afstand die een molecuul reist voordat ze met een andere botsen, is veel langer in gassen dan in vloeistoffen of vaste stoffen. Dit betekent dat er minder mogelijkheden zijn voor energieoverdracht door botsingen.
4. Slechte thermische geleidbaarheid: Gassen hebben over het algemeen een lage thermische geleidbaarheid, wat betekent dat ze slecht zijn in het overbrengen van warmte. Dit komt door de hierboven genoemde factoren - zwakke intermoleculaire krachten, lage dichtheid en lang gemiddeld vrij pad.
5. Langzame energieoverdracht: Wanneer botsingen optreden, is de energieoverdracht tussen gasmoleculen minder efficiënt dan in vloeistoffen of vaste stoffen. Dit komt omdat de moleculen sneller bewegen en een kortere interactietijd hebben.
Voorbeeld: Stel je voor dat je een bal probeert door een rij mensen te passeren. Als de mensen ver uit elkaar staan en niet hand vasthouden, zal de bal veel langer duren om het einde van de lijn te bereiken. Dit is vergelijkbaar met hoe warmtegeleiding werkt in gassen. De moleculen zijn ver uit elkaar en zijn niet sterk verbonden, waardoor energie overdracht langzaam wordt.
Samenvattend: De lage dichtheid, zwakke intermoleculaire krachten, lang gemiddelde vrij pad en langzame energieoverdracht tussen moleculen in gassen dragen allemaal bij aan hun slechte thermische geleidbaarheid en langzame geleiding van warmte.
 Wat voor de materialen die worden gebruikt om potholders te maken, zijn slechte warmtegeleiders?
Wat voor de materialen die worden gebruikt om potholders te maken, zijn slechte warmtegeleiders?  Hoe illustreert u chemische verandering versus fysiek in een Venn -diagram?
Hoe illustreert u chemische verandering versus fysiek in een Venn -diagram?  Welke vorm neemt gas aan?
Welke vorm neemt gas aan?  Een oplossing bevat 1,20 g CACL2 en 240 ml Wat is de percentage W-W-concentratie als een dichtheid 1,13 g-ml heeft?
Een oplossing bevat 1,20 g CACL2 en 240 ml Wat is de percentage W-W-concentratie als een dichtheid 1,13 g-ml heeft?  Een kleurrijke detector
Een kleurrijke detector
Hoofdlijnen
- Wiskundigen en biologen leggen uit waarom de darmen van gewervelde dieren zo voorspelbaar krom zijn
- Wat is het vetweefsel dat Symphysis Pubis bestrijkt en kussens wordt genoemd?
- Verschil tussen bacterie- en plantencel Wall
- Welke feiten beïnvloeden zaadkieming?
- 1 Leg uit waarom de bloedsomloop van een walvis als een orgaansysteem wordt beschouwd?
- Welke drie wetenschappers hielpen lang geleden de celtheorie?
- Wat is de functie van endoplasma bij protozoën?
- Welk proces vindt plaats in de cellen van Spirulina dat niet bij de mens voorkomt?
- Wat is een beschrijving van de sciencemethode van de reeks?
- Het bereiken van stabiele K-opslagprestaties van met koolstofbolletjes opgesloten antimoon via elektrolytregulatie
- Een nieuw bioproces om plantaardig materiaal om te zetten in waardevolle chemicaliën

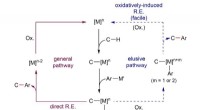
- Wetenschappers bereiken arylering van C-H-bindingen in milde omstandigheden
- Een wondermiddel voor de chemische omzetting van kooldioxide
- Inzicht in 3D-structuur van enzymen kan biobrandstofkosten verlagen
 Energieopslagproject in Utah beschreven als 's werelds grootste in zijn soort
Energieopslagproject in Utah beschreven als 's werelds grootste in zijn soort Moeten we de aarde verhullen om het te verbergen voor kwaadaardige buitenaardse wezens?
Moeten we de aarde verhullen om het te verbergen voor kwaadaardige buitenaardse wezens?  Europa's oudste boom groeit nog steeds
Europa's oudste boom groeit nog steeds  Wat is de vergelijking voor reactie met gas in lucht?
Wat is de vergelijking voor reactie met gas in lucht?  Welke formule cam wordt gebruikt om de snelheid van een object in vrije val te bepalen?
Welke formule cam wordt gebruikt om de snelheid van een object in vrije val te bepalen?  Hoe vervoer je een straal van de ene plaats naar de andere?
Hoe vervoer je een straal van de ene plaats naar de andere?  Nieuw pad om klimaatverandering te beperken en vooruitgang op het gebied van duurzame-ontwikkelingsdoelstellingen van de VN te stimuleren
Nieuw pad om klimaatverandering te beperken en vooruitgang op het gebied van duurzame-ontwikkelingsdoelstellingen van de VN te stimuleren Hoe beschrijf je samengesteld?
Hoe beschrijf je samengesteld?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

