
Wetenschap
Wat voor soort kracht werkt binnen een molecuul?
* Intramoleculaire krachten: Dit zijn de krachten die atomen bij elkaar houden binnen een molecuul. Ze zijn veel sterker dan intermoleculaire krachten, die moleculen bij elkaar houden. De twee belangrijkste soorten intramoleculaire krachten zijn:
* Covalente bindingen: Dit zijn het sterkste type chemische binding, gevormd door het delen van elektronen tussen atomen. Ze zijn verantwoordelijk voor de vorming van de meeste moleculen.
* ionische bindingen: Deze bindingen worden gevormd door de elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen. Ze worden meestal aangetroffen in verbindingen gevormd tussen metalen en niet -metalen.
* Andere intramoleculaire interacties: Naast covalente en ionische bindingen kunnen andere krachten ook bijdragen aan de stabiliteit en eigenschappen van een molecuul. Deze omvatten:
* waterstofbinding: Dit is een speciaal type dipool-dipoolinteractie dat optreedt wanneer een waterstofatoom wordt gebonden aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor). Het is een relatief sterke intermoleculaire kracht, maar nog steeds zwakker dan covalente bindingen.
* van der Waals krachten: Dit zijn zwakke, tijdelijke krachten die voortkomen uit schommelingen in elektronenverdeling rond atomen. Ze zijn belangrijk om moleculen bij elkaar te houden in vloeistoffen en vaste stoffen.
Samenvattend: Hoewel covalente bindingen de primaire kracht zijn die verantwoordelijk is voor de vorming en stabiliteit van moleculen, kunnen andere intramoleculaire interacties zoals waterstofbinding en van der Waals -krachten ook een belangrijke rol spelen bij het bepalen van de eigenschappen van een molecuul.
 Wat is de chemische vergelijking voor de reactie van kopersulfaat bij verwarmde kopersulfaat?
Wat is de chemische vergelijking voor de reactie van kopersulfaat bij verwarmde kopersulfaat?  Welk proces is verantwoordelijk voor het terugbrengen van stikstof naar de lucht?
Welk proces is verantwoordelijk voor het terugbrengen van stikstof naar de lucht?  Wat is de waarschijnlijke lading van een ionenzwavel?
Wat is de waarschijnlijke lading van een ionenzwavel?  Welke vormen wanneer een oplossing die opgelost bakpoeder en citroensap bevat, worden gemengd, geeft aan dat chemische verandering heeft plaatsgevonden?
Welke vormen wanneer een oplossing die opgelost bakpoeder en citroensap bevat, worden gemengd, geeft aan dat chemische verandering heeft plaatsgevonden?  Welk element is vernoemd naar een reinigingsverbinding die bleek groter te zijn?
Welk element is vernoemd naar een reinigingsverbinding die bleek groter te zijn?
 Wat deden de mensen met hun bos voordat Great Dust Bowl gebeurde?
Wat deden de mensen met hun bos voordat Great Dust Bowl gebeurde?  HIGH-TOOL ondersteunt transportplanning in Europa
HIGH-TOOL ondersteunt transportplanning in Europa Veerkracht tegen klimaatverandering? Uit nieuw onderzoek blijkt dat octopussen zich aanpassen aan hogere zuurniveaus in de oceaan
Veerkracht tegen klimaatverandering? Uit nieuw onderzoek blijkt dat octopussen zich aanpassen aan hogere zuurniveaus in de oceaan  Wat is het behoud van de reuzenpanda waard? Miljarden per jaar, blijkt uit onderzoek
Wat is het behoud van de reuzenpanda waard? Miljarden per jaar, blijkt uit onderzoek  Old Faithfuls geologisch hart onthuld
Old Faithfuls geologisch hart onthuld
Hoofdlijnen
- Wetenschappers ontdekken hoe rapamycine de celgroei vertraagt
- Tomatenpulp bestaat uit welk type cellen?
- Hoe nematoden de verdediging van ongedierte te slim af zijn
- Zijn er 3 manieren waarop schimmels zich voortplanten?
- Welke afkortingen voor enzymen die betrokken zijn bij de afbraak van glucose?
- Wat zijn een of twee nucleotiden die in een bepaalde mutatie worden veranderd?
- Wat zijn de toepassing en theorieën in verschillende takken wetenschap?
- Hoe de hersenen geuren buitensluiten
- Wat is het proces waarbij bepaalde mutualistische bacteriën gasvormige stikstof omzetten in een vorm die planten kunnen gebruiken?
- Eenvoudige methode om koolstofdioxide om te zetten in bruikbare verbindingen

- Buitengewoon dikke organische light-emitting diodes lossen zeurende problemen op

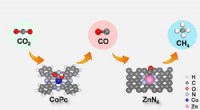
- Tandemkatalysator om de elektroreductie van kooldioxide tot methaan te verbeteren
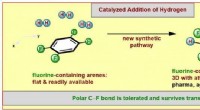
- Een nieuwe methode voor de vorming van gefluoreerde moleculaire ringen
- Team gebruikt een ernstige vervormingsmethode op bulk magnetische legeringen voor hoge prestaties

 Cryptocurrency en blockchain verkennen in IJsland
Cryptocurrency en blockchain verkennen in IJsland Wat zijn drie manieren waarop moleculen door een semipermeabiel membraan bewegen?
Wat zijn drie manieren waarop moleculen door een semipermeabiel membraan bewegen?  Wat voor soort energie absorbeert gras van de zon?
Wat voor soort energie absorbeert gras van de zon?  Single-atom-dikke halfgeleidersandwich is een belangrijke stap in de richting van ultra-low-energy elektronica
Single-atom-dikke halfgeleidersandwich is een belangrijke stap in de richting van ultra-low-energy elektronica Waarom duurt het zo lang voordat wetenschappelijke ontdekkingen het grote publiek bereiken?
Waarom duurt het zo lang voordat wetenschappelijke ontdekkingen het grote publiek bereiken? Welke celstructuur betekent dat het alle activiteit stuurt?
Welke celstructuur betekent dat het alle activiteit stuurt?  Hoe en waarom wint Typhoon energie uit de warme oceaan?
Hoe en waarom wint Typhoon energie uit de warme oceaan?  Welke verklaring legt uit waarom Sulphur is geclassificeerd als een groep 16 -element?
Welke verklaring legt uit waarom Sulphur is geclassificeerd als een groep 16 -element?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

