
Wetenschap
Waarom is de elektronenaffiniteit voor Clorine groter dan jodium?
* Grootte: Chloor is kleiner dan jodium. Dit betekent dat het buitenste elektron in chloor dichter bij de kern ligt en een sterkere elektrostatische aantrekkingskracht ervaart. Deze sterkere attractie maakt het voor chloor gunstiger om een elektron te krijgen.
* Effectieve nucleaire lading: Chloor heeft een hogere effectieve nucleaire lading (de netto positieve lading ervaren door de valentie -elektronen) dan jodium. Dit komt omdat de kernelektronen in chloor beter zijn in het beschermen van de valentie -elektronen van de kern in vergelijking met jodium. De hogere effectieve nucleaire lading in chloor draagt ook bij aan een sterkere aantrekkingskracht voor een inkomend elektron.
* Elektronen-elektronafweerstappen: Terwijl u het periodiek systeem af gaat, worden elektronenschalen toegevoegd, waardoor het aantal elektronen in een atoom wordt verhoogd. Het toegenomen aantal elektronen in jodium leidt tot grotere elektron-elektronenafweer, waardoor het minder gunstig is om nog een elektron toe te voegen.
Samenvattend:
* kleiner formaat en hogere effectieve nucleaire lading in chloor leiden tot een sterkere aantrekkingskracht voor een elektron.
* Verhoogde elektron-elektronafweerstand Maakt het in jodium het minder gunstig om een elektron te krijgen.
Deze combinatie van factoren resulteert in een hogere elektronenaffiniteit voor chloor in vergelijking met jodium.
 Waarom is Amber geen rots of mineraal?
Waarom is Amber geen rots of mineraal?  De tegenstelling van de Green New Deal - het kan de koolstofemissies zelfs verhogen
De tegenstelling van de Green New Deal - het kan de koolstofemissies zelfs verhogen Dieren van de Coastal Desert Biome
Dieren van de Coastal Desert Biome  Bezorgdheid over klimaatverandering niet beïnvloed door pandemie, studie toont
Bezorgdheid over klimaatverandering niet beïnvloed door pandemie, studie toont Hoe een planeet in een computer te passen - het ontwikkelen van het energie-exascale aardesysteemmodel?
Hoe een planeet in een computer te passen - het ontwikkelen van het energie-exascale aardesysteemmodel?
Hoofdlijnen
- Wat is een gastheercel voor virus?
- Hoe heet een cel die geen kern heeft?
- Wanneer komt er chromosomale replicatie op?
- Wat is de Darwin-kernel?
- Wat is een voorbeeld van een wetenschappelijk onderzoek waarbij wetenschappers uit verschillende takken samenwerken?
- Kan ruimte ons helpen onze cellen te begrijpen?
- Hoe wordt dit deze structuren een groep cellen genoemd die hormonen maken?
- Onderzoekers laten zien hoe de hersenen zoveel gegevens kunnen verwerken
- Wanneer een wetenschapper een goed opgeleide gok doet over wat het juiste antwoord op het wetenschapsexperiment zou kunnen zijn?
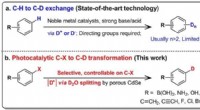
- Nauwkeurige deuteratie met zwaar water
- UV-licht van de zon hielp het leven te vonken

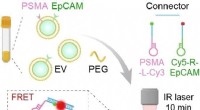
- Snel, ongecompliceerd en specifiek:diagnose van prostaatkanker op basis van bloedmonsters
- Afval van het maken van paarse maïschips levert een natuurlijke kleurstof op, supplementen, kattenbakvulling

- Studie toont afstembaarheid van een moleculaire chaperonne aan

 Alle krachten zijn in evenwicht en alle gelijkwaardige nul?
Alle krachten zijn in evenwicht en alle gelijkwaardige nul?  Waarom fantastische sprookjesachtige samenlevingen net zo complex kunnen zijn als de onze
Waarom fantastische sprookjesachtige samenlevingen net zo complex kunnen zijn als de onze Hoe de Net Torque
Hoe de Net Torque Kwantumfysicus gebruikt grafeenlinten om energiecentrales op nanoschaal te bouwen
Kwantumfysicus gebruikt grafeenlinten om energiecentrales op nanoschaal te bouwen  Ontdekking van zeldzame Romeinse runderbotten werpt nieuw licht op oude landbouw
Ontdekking van zeldzame Romeinse runderbotten werpt nieuw licht op oude landbouw Hoe is een vaste stof en gas hetzelfde?
Hoe is een vaste stof en gas hetzelfde?  Wat voor soort beweging verandert de snelheid en richting niet?
Wat voor soort beweging verandert de snelheid en richting niet?  Wat is er slecht aan zonne -energie?
Wat is er slecht aan zonne -energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

