
Wetenschap
De reactiviteit van een atoom is te wijten aan het aantal en de opstelling in het buitenste energieniveau of de baan?
* valentie -elektronen: Dit zijn de elektronen in het buitenste energieniveau. Zij zijn degenen die betrokken zijn bij chemische binding, wat de basis is van reactiviteit.
* octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele configuratie te bereiken met acht valentie -elektronen (zoals de edelgassen). Deze stabiliteit is de drijvende kracht achter chemische reacties.
* Aantal valentie -elektronen: Het aantal valentie -elektronen bepaalt hoe gemakkelijk een atoom bindingen zal vormen. Atomen met bijna een volledige buitenste schaal (bijv. Halogenen) hebben de neiging elektronen te krijgen, terwijl atomen met weinig valentie -elektronen (bijv. Alkali -metalen) de neiging hebben ze te verliezen.
* Regeling van valentie -elektronen: De specifieke opstelling van valentie -elektronen beïnvloedt de soorten bindingen die een atoom kan vormen (enkele, dubbele, drievoudige bindingen).
Voorbeeld:
* natrium (na) Heeft één valentie -elektron, waardoor het zeer reactief is. Het verliest gemakkelijk dit elektron om een stabiel octet te bereiken.
* chloor (Cl) heeft zeven valentie -elektronen. Het krijgt gemakkelijk één elektron om een stabiel octet te bereiken, waardoor het reactief is.
* neon (ne) Heeft een volledige buitenste schaal met acht elektronen. Het is zeer stabiel en niet reactief.
Samenvattend: Het aantal en de opstelling van valentie -elektronen bepalen hoe gemakkelijk een atoom zal deelnemen aan chemische reacties, vandaar de reactiviteit ervan.
 Wat is de vergelijking voor ijzer III -chloride plus zilvernitraat?
Wat is de vergelijking voor ijzer III -chloride plus zilvernitraat?  Zout wordt gevormd uit positief geladen natrium en negatief chloor de lading op zout wordt negatief en waar B onwaar?
Zout wordt gevormd uit positief geladen natrium en negatief chloor de lading op zout wordt negatief en waar B onwaar?  Wat is het belang van het afvegen van ijs voordat het in het water in de calorimeter wordt geïntroduceerd?
Wat is het belang van het afvegen van ijs voordat het in het water in de calorimeter wordt geïntroduceerd?  MXene-materialen helpen fotodetectoren het licht te zien
MXene-materialen helpen fotodetectoren het licht te zien Een nieuwe miniatuuroplossing voor het opslaan van duurzame energie
Een nieuwe miniatuuroplossing voor het opslaan van duurzame energie
Hoofdlijnen
- Wat zijn enkele niet-voorbeelden van gemeenschapsbiologie?
- Welke uitspraken zijn waar voor alle wetenschappelijke inspanningen?
- Nieuwe technieken laten zien hoe microben de gezondheid en biodiversiteit van oceanen bepalen
- Spierreconstructie laat zien hoe dinosaurussen stonden
- Een groep gespecialiseerde cellen vormt eerst een?
- Welk onderwerp wordt de centrale wetenschap genoemd?
- Hoe ziet de reparatiewerkplaats van DNA eruit? Nieuw onderzoek identificeert de tools
- Waarom gebruiken wetenschappers Bat Box?
- Mariene microplastics:hoe de verspreiding van watermassa de transporttrajecten beïnvloedt
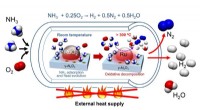
- Ontdekking van een eenvoudig proces voor H2-productie met ammoniak als drager
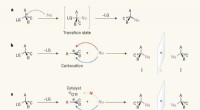
- Hoe een chemische kettingreactie aan te wakkeren?
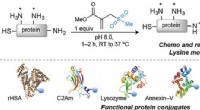
- Een SN1-reactie gebruiken om quaternaire stereocentra te maken
- Chemici maken een sensor die nauwkeurig de speeksel-pH van mensen detecteert

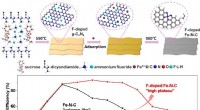
- Onderzoekers gebruiken de fluordopingmethode om katalysatoren te bouwen met verbeterde prestaties
 Nieuwe kolenverordeningen zullen tot 1.400 Amerikanen per jaar doden
Nieuwe kolenverordeningen zullen tot 1.400 Amerikanen per jaar doden Wie was de constellatie die Cassiopeia daarna vernoemd?
Wie was de constellatie die Cassiopeia daarna vernoemd?  Waar worden mesenchymale stamcellen voor gebruikt?
Waar worden mesenchymale stamcellen voor gebruikt?  Wat is de staat van het koelmiddel dat de condensor binnenkomt?
Wat is de staat van het koelmiddel dat de condensor binnenkomt?  Wat is een kracht die samenkomt?
Wat is een kracht die samenkomt?  Wat is de relatie tussen snelheid en verplaatsing?
Wat is de relatie tussen snelheid en verplaatsing?  Hurricane Lane raast richting Hawaï met wind van 120 mph
Hurricane Lane raast richting Hawaï met wind van 120 mph Nieuwe satellietbeelden onthullen nieuwe hoogste berg op het Antarctisch Schiereiland
Nieuwe satellietbeelden onthullen nieuwe hoogste berg op het Antarctisch Schiereiland
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

