
Wetenschap
Waarom is een nitraation sterkere basis dan sulfide -ion?
* basiciteit: Basisiteit verwijst naar het vermogen van een soort om een proton te accepteren (H⁺). Sterkere bases accepteren eerder protonen.
* factoren die de basiciteit beïnvloeden: Verschillende factoren dragen bij aan de basiciteit van een ion:
* elektronegativiteit: Meer elektronegatieve atomen houden elektronen strakker vast, waardoor ze minder geneigd zijn ze te doneren en dus minder basic. Zuurstof is elektronegatiefer dan zwavel.
* Grootte: Grotere atomen hebben hun valentie -elektronen verder van de kern, waardoor ze eerder worden gedoneerd en dus eenvoudiger. Zwavel is groter dan zuurstof.
* opladen: Meer negatieve lading verhoogt het vermogen om protonen aan te trekken, waardoor de soort eenvoudiger wordt. Zowel sulfide als nitraat hebben een -2 lading.
* deze factoren toepassen:
* sulfide -ion (s²⁻): De grotere omvang van zwavel en de -2 lading maken het een sterkere basis.
* nitraation (no₃⁻): De elektronegativiteit van zuurstof zorgt ervoor dat het minder snel elektronen doneert en dus minder basic. Bovendien vermindert de delocalisatie van elektronen in het nitraation verder de basiciteit ervan.
Samenvattend is sulfide -ion een sterkere basis dan nitraation vanwege de grotere omvang en minder elektronegatieve aard van zwavel in vergelijking met zuurstof.
 CRISPR ontgint bacterieel genoom voor verborgen farmaceutische schat
CRISPR ontgint bacterieel genoom voor verborgen farmaceutische schat Wie zei dat de meeste van een atomenmassa zich in het kernatoom bevindt?
Wie zei dat de meeste van een atomenmassa zich in het kernatoom bevindt?  Op welke fysische eigenschap van materie wordt gebruik gemaakt bij het scheiden van mengsels door destillatie?
Op welke fysische eigenschap van materie wordt gebruik gemaakt bij het scheiden van mengsels door destillatie?  Brandstofcellen opladen met cafeïne
Brandstofcellen opladen met cafeïne  Waarom zouden nobele gassen het laatst worden ontdekt?
Waarom zouden nobele gassen het laatst worden ontdekt?
 Kleine stroompjes en wetlands zijn belangrijke onderdelen van riviernetwerken - dit is waarom ze bescherming nodig hebben
Kleine stroompjes en wetlands zijn belangrijke onderdelen van riviernetwerken - dit is waarom ze bescherming nodig hebben Hoe de productie van chemicaliën de natuur verstoort, berekend in absolute cijfers
Hoe de productie van chemicaliën de natuur verstoort, berekend in absolute cijfers  Tsjechische zwijnen 31 jaar na Tsjernobyl . nog steeds radioactief
Tsjechische zwijnen 31 jaar na Tsjernobyl . nog steeds radioactief Vulkanen gevoed door brijreservoirs in plaats van gesmolten magmakamers
Vulkanen gevoed door brijreservoirs in plaats van gesmolten magmakamers Iraakse Koerdische boeren vechten tegen droogte terwijl Lake Dukan zich terugtrekt
Iraakse Koerdische boeren vechten tegen droogte terwijl Lake Dukan zich terugtrekt
Hoofdlijnen
- Om hun bodem te redden, schakelt de Kansas-stam over op regeneratieve landbouw en transformeert hun boerderijen
- Op welk proces worden nieuwe cellen gemaakt?
- Doet dierlijke cellen in het algemeen een celwand om de cel om te sluiten?
- Ambien
- Hoe zijn Enzyems en kauwen anders?
- Welke uitspraak verklaart het beste waarom een levend organisme in een natte omgeving binnen de veldzichtmicroscoop in en uit focus beweegt?
- Onderzoekers creëren een nauwkeuriger model van hoe sommige microben naar voedingsstoffen zoeken
- Hoe weet het lichaam hoe hij mRNA moet produceren?
- Waarom is DNA de blauwdruk van het leven?
- Mysterieus organisch uitschot verhoogt de efficiëntie van chemische reacties, kan chemisch afval verminderen
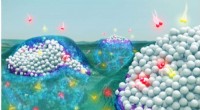
- Natuurkundigen maken stop-actiebeelden van door licht aangestuurde moleculaire reactie

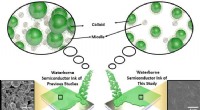
- Milieuvriendelijke halfgeleiderinkten op waterbasis met oppervlakteactieve stof
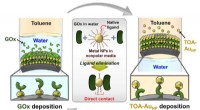
- Elektrodeontwerp maakt de weg vrij voor betere biobrandstofcellen, elektrochemische apparaten
- Nieuw onderzoek optimaliseert zowel elasticiteit als stijfheid in hetzelfde materiaal zonder de gebruikelijke compromissen

 Nieuwe draai aan CRISPR-technologie
Nieuwe draai aan CRISPR-technologie Krimpende dinosaurussen en de evolutie van endothermie bij vogels
Krimpende dinosaurussen en de evolutie van endothermie bij vogels Hoe heet de atmosfeerlaag waarin jij leeft?
Hoe heet de atmosfeerlaag waarin jij leeft?  Biomaterialen voor het coaten van papier, afgeleid van anaëroob korrelslib, kunnen kosteneffectief zijn
Biomaterialen voor het coaten van papier, afgeleid van anaëroob korrelslib, kunnen kosteneffectief zijn  Wat is de dominante generatie van divisie Cycadophyta?
Wat is de dominante generatie van divisie Cycadophyta?  Wat brengt mechanische golven niet over?
Wat brengt mechanische golven niet over?  Welke rotsen vormen zich van dode planten en dieren die zijn gecomprimeerd?
Welke rotsen vormen zich van dode planten en dieren die zijn gecomprimeerd?  Wereldwijde verviervoudiging van koelapparatuur tot 14 miljard in 2050
Wereldwijde verviervoudiging van koelapparatuur tot 14 miljard in 2050
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

