
Wetenschap
Waarom is water een betere geleider dan ethanol?
1. Ionisatie:
* Water: Watermoleculen (H₂o) zijn polair, wat betekent dat ze een positief en een negatief einde hebben als gevolg van de ongelijke delen van elektronen. Met deze polariteit kan water ionische verbindingen, zoals zouten, gemakkelijk oplossen en ze in ionen dissociëren. Deze gratis ionen, zoals Na⁺ en CL⁻ van NaCl, zijn de primaire dragers van elektrische stroom in water.
* ethanol: Ethanol (ch₃ch₂oh) is ook polair maar in mindere mate dan water. Het dissocieert niet gemakkelijk in ionen en heeft daarom minder vrije ladingsdragers.
2. Waterstofbinding:
* Water: Watermoleculen vormen sterke waterstofbruggen met elkaar, die bijdragen aan de hoge diëlektrische constante. Met deze hoge diëlektrische constante kunnen water de ladingen van ionen effectief screenen, waardoor hun beweging en geleidbaarheid worden vergemakkelijkt.
* ethanol: Ethanol vormt ook waterstofbindingen, maar ze zijn zwakker dan die in water. Dit resulteert in een lagere diëlektrische constante en verminderde geleidbaarheid.
3. Ionmobiliteit:
* Water: Het sterke waterstofbindingsnetwerk in water stelt ionen in staat om vrij en efficiënter te bewegen, wat bijdraagt aan de hoge geleidbaarheid.
* ethanol: Ethanol's zwakkere waterstofbruggen en lagere diëlektrische constante beperken ionenmobiliteit en verminderen de geleidbaarheid.
Samenvattend: Water's hoge polariteit, sterke waterstofbinding en hogere diëlektrische constante leiden tot een grotere overvloed aan vrije ionen en grotere ionenmobiliteit, waardoor het een veel betere geleider van elektriciteit is dan ethanol.
 Nieuwe analyse vindt mogelijkheden voor koolstofafvang, opslag
Nieuwe analyse vindt mogelijkheden voor koolstofafvang, opslag Is het waar dat zodra een object op zijn natuurlijke rustplaats is, niet vanzelf kan bewegen?
Is het waar dat zodra een object op zijn natuurlijke rustplaats is, niet vanzelf kan bewegen?  Wat zijn gematigde klimaatkenmerken?
Wat zijn gematigde klimaatkenmerken?  Gasfakkels presteren enorm ondermaats, met een grotere impact op het klimaat:onderzoek
Gasfakkels presteren enorm ondermaats, met een grotere impact op het klimaat:onderzoek Ecologen vragen zich af:moeten we transparanter zijn met data?
Ecologen vragen zich af:moeten we transparanter zijn met data?
Hoofdlijnen
- Wat is een cel met complexe membraangebonden organellen genoemd?
- Vermeld de drie delen van de celtheorie en beschrijf kort hoe het zich met u verhoudt?
- Welke organel zou je verwachten veel te zien in spiercellen?
- Wat is een molecuul dat bestaat uit stuk -DNA uit het ene organisme in combinatie met het lid van een andere soort?
- Is nucleoli in planten- of dierencel?
- Wat doen we nu met de stikstofademhaling?
- Welke menselijke ziekten worden veroorzaakt door bacteriën?
- Hoe voorkomen planten zelfbevruchting?
- Nieuwe studie werpt licht op hoe de vroegste vormen van leven op aarde zijn geëvolueerd
- Simulaties laten zien hoe atomen zich gedragen in zelfherstellend cement

- Synthetische verbinding zorgt voor snelle screening op potentiële medicijnen
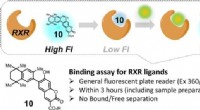
- Nauwkeurige deuteratie met zwaar water
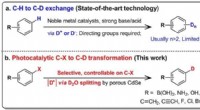
- Onderzoekers onthullen gastreactiegestuurde kooi aan Siamese tweelingkooi, mitose-achtige gastheertransformatie
- Complexe moleculen samenstellen

 Hoeveel gram zijn er in 4,5 gram?
Hoeveel gram zijn er in 4,5 gram?  De ruimte rond een deeltje waardoor een elektrische lading kracht kan uitoefenen, is?
De ruimte rond een deeltje waardoor een elektrische lading kracht kan uitoefenen, is?  Nieuwe slimme sensor kan een revolutie teweegbrengen in de preventie van misdaad en terrorisme
Nieuwe slimme sensor kan een revolutie teweegbrengen in de preventie van misdaad en terrorisme Waar zijn giste en suboptimale voorbeelden van?
Waar zijn giste en suboptimale voorbeelden van?  Waarom veroorzaakt de rotatie van de zon en de aarde vier seizoenen?
Waarom veroorzaakt de rotatie van de zon en de aarde vier seizoenen?  Wat is een synoniem voor energie?
Wat is een synoniem voor energie?  Wat is de machtigste man die op aarde op aarde heeft gemaakt?
Wat is de machtigste man die op aarde op aarde heeft gemaakt?  Wetenschapsnieuws dat je gemist hebt tijdens de feestdagen
Wetenschapsnieuws dat je gemist hebt tijdens de feestdagen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

