
Wetenschap
Hoe bepaalt u de zuurgraad en basiciteit van een stof?
Inzicht in zuurgraad en basiciteit
* zuurgraad: Een stof is zuur als deze protonen (H+) aan een andere stof schenkt. Zuren hebben de neiging om een zure smaak te hebben, te reageren met basen om zouten en water te vormen en blauw lakmoespapier rood te maken.
* basiciteit: Een stof is basic (of alkalisch) als deze protonen accepteert (H+). Bases hebben een bittere smaak, voelen glad aan, reageren met zuren om zouten en water te vormen en rood lakmoespapier blauw te worden.
methoden om de zuurgraad en basiciteit te bepalen
1. pH -schaal: De meest voorkomende manier om de zuurgraad en basiciteit te meten, is het gebruik van de pH -schaal. Hier is een uitsplitsing:
* pH 0-6: Zuur
* pH 7: Neutraal (bijv. Puur water)
* pH 8-14: Fundamenteel
2. Litmus -papier: Dit eenvoudige indicatorpapier verandert van kleur, afhankelijk van de pH van de oplossing.
* Red Litmus -papier wordt blauw in basisoplossingen.
* Blue Litmus -papier wordt rood in zure oplossingen.
3. Universele indicator: Deze oplossing verandert van kleur over een breder pH -bereik, wat een preciezere schatting van de pH oplevert.
4. Chemische eigenschappen:
* zuren:
* Reageer met metalen om waterstofgas te produceren (H2).
* Reageer met carbonaten (zoals bakpoeder) om koolstofdioxide te produceren (CO2).
* Draai Blue Litmus -papier rood.
* Sours Sour (probeer dit niet thuis!)
* Bases:
* Voel je glad (zoals zeep).
* Reageer met zuren om zouten en water te vormen.
* Draai Red Litmus Paper Blue.
* Proef bitter (nogmaals, niet smaken!).
factoren die de zuurgraad en basiciteit beïnvloeden
* Moleculaire structuur: De structuur van een molecuul bepaalt het vermogen om protonen te doneren of te accepteren. Carbonzuren (COOH) zijn bijvoorbeeld over het algemeen zuur vanwege de aanwezigheid van het zure waterstofatoom bevestigd aan de carbonylgroep.
* elektronegativiteit: De elektronegativiteit van atomen in een molecuul kan de zuurgraad of basiciteit beïnvloeden. Meer elektronegatieve atomen trekken elektronendichtheid weg van het waterstofatoom, waardoor het eerder als een proton wordt gedoneerd (toenemende zuurgraad).
* inductieve effecten: Elektronen-withendinggroepen (zoals halogenen) kunnen een molecuul zuurder maken door elektronendichtheid weg te trekken van het zure waterstofatoom.
* Resonantie -effecten: Resonantie kan de conjugaatbasis van een zuur stabiliseren, waardoor het zuur zuurder wordt.
belangrijke opmerkingen:
* Sterkte versus concentratie: Verwar de sterkte van een zuur of basis niet met zijn concentratie. Een sterk zuur of base zal volledig ionen in oplossing, terwijl een zwak zuur of base slechts gedeeltelijk ioniseert. Concentratie verwijst naar hoeveel zuur of basis aanwezig is.
* Veiligheid: Behandel altijd zuren en basen met voorzichtigheid. Draag passende beschermende uitrusting (handschoenen, bril) en werk in een goed geventileerd gebied.
Laat het me weten als je meer gedetailleerde uitleg wilt over een van deze concepten, of als je specifieke stoffen hebt die je wilt analyseren!
 Een nieuwe methode voor kwantitatieve schatting van de mate van overeenkomst van coördinatieveelvlakken
Een nieuwe methode voor kwantitatieve schatting van de mate van overeenkomst van coördinatieveelvlakken Een nieuw idee voor het raffineren van biocrude
Een nieuw idee voor het raffineren van biocrude Welke elementen zijn gassen bij kamertemperatuur en de atomen samengevoegd?
Welke elementen zijn gassen bij kamertemperatuur en de atomen samengevoegd?  Wat gebeurt er met inkt op glas wanneer verwarmd?
Wat gebeurt er met inkt op glas wanneer verwarmd?  Wat is het atoomnummer voor sucrose?
Wat is het atoomnummer voor sucrose?
 Klimaatverandering:waarom we niet kunnen vertrouwen op het hergroeien van kusthabitats om de CO2-uitstoot te compenseren
Klimaatverandering:waarom we niet kunnen vertrouwen op het hergroeien van kusthabitats om de CO2-uitstoot te compenseren  Wat is de relatie tussen klimaatbiodiversiteit en toerisme in het Caribisch gebied van Midden -Amerika?
Wat is de relatie tussen klimaatbiodiversiteit en toerisme in het Caribisch gebied van Midden -Amerika?  Kleine eilanden pleiten voor actie bij VN-klimaatoverleg
Kleine eilanden pleiten voor actie bij VN-klimaatoverleg Orkaan Dorian veroorzaakt enorme overstromingen over Bahama's
Orkaan Dorian veroorzaakt enorme overstromingen over Bahama's Luchtvervuiling door remstof kan dezelfde schadelijke effecten hebben op immuuncellen als dieseluitlaatgassen
Luchtvervuiling door remstof kan dezelfde schadelijke effecten hebben op immuuncellen als dieseluitlaatgassen
Hoofdlijnen
- Hoe verspreiden microben die verband houden met het menselijk lichaam? Het transmissielandschap van microbiomen
- Wat is een dunne laag vet die de cel omringt?
- Kunnen we de taal van onze neven en nichten van primaten decoderen?
- Waarom is het belangrijk voor wetenschappers om hun resultaten te delen?
- Is dit waar of onwaar dat veel wetenschappers fotosynthese het belangrijkste levensproces op aarde beschouwen?
- Reproduceren bakkers gist seksueel of aseksueel beide?
- Wat doet wetenschapper na de hypothese?
- Wat doen vetmoleculen?
- Actine-onderzoek laat zien hoe vlindervleugels hun levendige kleuren krijgen
- Onderzoek vooruitgang zoeken naar nieuwe antibiotica
- Saffieren tonen hun ware kleuren:niet waterminnend
- Chemicus creëert katalysator om anti-muggenstoffen te produceren
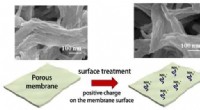
- Ontwikkeling van ultradun duurzaam membraan voor efficiënte scheiding van olie en water
- Bibliotheek met spinnenzijde kan geheimen bevatten voor nieuwe materialen

 VK verbiedt verkoop van benzine- en dieselauto's tegen 2040
VK verbiedt verkoop van benzine- en dieselauto's tegen 2040 Wat is 110lb in steen?
Wat is 110lb in steen?  Wat was de belangrijkste bestemming van mensen die het noordelijke deel Dust Bowl verlieten?
Wat was de belangrijkste bestemming van mensen die het noordelijke deel Dust Bowl verlieten?  Definitie van pneumatische cilinder
Definitie van pneumatische cilinder  Wat is het verschil tussen een maan-eclipse en zonne-eclipse?
Wat is het verschil tussen een maan-eclipse en zonne-eclipse?  Wat gebeurt er met verspilde thermische energie?
Wat gebeurt er met verspilde thermische energie?  Hoe om RPM naar MPH te converteren met een rekenmachine
Hoe om RPM naar MPH te converteren met een rekenmachine Hoe als kracht gerelateerd aan snelheid en versnelling?
Hoe als kracht gerelateerd aan snelheid en versnelling?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

