
Wetenschap
IJzer II sulfide wordt geproduceerd wanneer ijzer verwarmd met zwavel Wat de therotische opbrengst van FES als 25,0 g Fe 32,0 s?
1. Schrijf de gebalanceerde chemische vergelijking:
FE + S → FES
2. Converteer grams naar mollen:
* voor Fe:
* Mol Fe =(25,0 g Fe) / (55,845 g / mol Fe) =0,447 mol Fe
* voor s:
* Mol S =(32,0 g s) / (32.065 g / mol s) =0,998 mol s
3. Bepaal de beperkende reactant:
* De beperkende reactant is degene die eerst volledig wordt geconsumeerd, waardoor de maximale hoeveelheid product wordt bepaald.
* Uit de evenwichtige vergelijking is de molverhouding van Fe tot S 1:1.
* Omdat we minder mol Fe (0,447 mol) hebben dan S (0,998 mol), is Fe de beperkende reactant.
4. Bereken de theoretische opbrengst van FES:
* De molverhouding van Fe tot FES is ook 1:1.
* Daarom is de theoretische opbrengst van FES gelijk aan de mol Fe:0,447 mol FES.
5. Converteer mollen naar gram:
* Theoretische opbrengst van FES in gram =(0.447 mol FES) * (87,91 g/mol FES) = 39,3 g FES
Daarom is de theoretische opbrengst van FES als 25,0 g Fe en 32,0 g s React 39,3 g fes.
 Welk zout zou vormen uit een reactie tussen zoutzuur en HCI calciumhydroxide CA OH 2 Leg uw antwoord uit?
Welk zout zou vormen uit een reactie tussen zoutzuur en HCI calciumhydroxide CA OH 2 Leg uw antwoord uit?  Wat is het gelijkwaardigheidspunt in een zure basisreactie?
Wat is het gelijkwaardigheidspunt in een zure basisreactie?  10 soorten fysieke verandering
10 soorten fysieke verandering  Nieuwe katalytische techniek creëert in minder tijd een belangrijk onderdeel van het incontinentiemedicijn
Nieuwe katalytische techniek creëert in minder tijd een belangrijk onderdeel van het incontinentiemedicijn  Vertraagt meel het smelten van ijs?
Vertraagt meel het smelten van ijs?
 We gaan naar Miss Our Temperature Goals: Here's What it means For You
We gaan naar Miss Our Temperature Goals: Here's What it means For You  Heilige bossen zijn veerkrachtig en tonen capaciteit voor hersteluitbreiding, zo blijkt uit een Grieks onderzoek
Heilige bossen zijn veerkrachtig en tonen capaciteit voor hersteluitbreiding, zo blijkt uit een Grieks onderzoek  Waarom is erosie goed?
Waarom is erosie goed?  Stedelijke gebieden hebben meer kans op door neerslag veroorzaakte aardverschuivingen, groeiende populaties bloot te stellen aan glijgevaren
Stedelijke gebieden hebben meer kans op door neerslag veroorzaakte aardverschuivingen, groeiende populaties bloot te stellen aan glijgevaren Flat Earthers versus sceptici over klimaatverandering:waarom complottheoretici elkaar blijven tegenspreken
Flat Earthers versus sceptici over klimaatverandering:waarom complottheoretici elkaar blijven tegenspreken
Hoofdlijnen
- Eerste muismodel met mitochondriale tRNALeu-mutatie ontwikkeld
- Onderzoekers onthullen hoe mirte-roestziekteverwekker een waardplant binnendringt
- Onderzoekers ontdekken hoe gelei-zeedieren moderne robotica kunnen vormen
- Wat is de drijvende plantproducent herbivore carnivore omnivore decomposer?
- Welke celstructuurplanten hebben die dieren
- Van motief naar methode,
- Mannelijke reproductieve functies worden voornamelijk gecontroleerd door hormonen uit de hypothalamus en?
- Waarom zijn organen complexer dan weefsels?
- Wat is het grootste en zichtbare orgaan in je lichaam?
- Het potentieel van metalen nanodeeltjes als katalysatoren voor snelle en efficiënte CO2-omzetting ontsluiten

- Video:Hebben astronauten zonnebrandcrème nodig?

- Onderzoek beschrijft nieuwe manier om insulineproducerende cellen te genereren
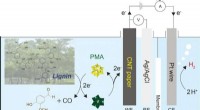
- Een nieuw biobrandstofsysteem voor waterstofproductie uit biomassa
- Nieuwe zelf-assemblerende eiwithydrogels kunnen vele toepassingen voor biogeneeskunde bevatten

 Robotsmeden:een technologie die de Amerikaanse productie kan doen herleven
Robotsmeden:een technologie die de Amerikaanse productie kan doen herleven Heeft Mauna Loa Mafic of Felsic Magma?
Heeft Mauna Loa Mafic of Felsic Magma?  Hoe vind je het formulegewicht van een compound?
Hoe vind je het formulegewicht van een compound?  Oude afsterving groter dan het uitsterven van dinosauriërs
Oude afsterving groter dan het uitsterven van dinosauriërs Het gebruik van intermoleculaire krachten leg uit waarom water een vloeistof is bij kamertemperatuur maar ammoniakgas.
Het gebruik van intermoleculaire krachten leg uit waarom water een vloeistof is bij kamertemperatuur maar ammoniakgas.  Heeft de politie een universiteit nodig?
Heeft de politie een universiteit nodig?  Dit type fout treedt op wanneer rots naar beneden beweegt aan de lijn?
Dit type fout treedt op wanneer rots naar beneden beweegt aan de lijn?  Wat is het huidige concept van atoom?
Wat is het huidige concept van atoom?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

