
Wetenschap
Hoe regelt Octet voor de vorming van NaCl?
1. Startpunt:
* natrium (na) heeft één valentie -elektron in zijn buitenste schaal.
* chloor (Cl) heeft zeven valentie -elektronen in zijn buitenste schaal.
2. Octetregel:
* Atomen hebben de neiging om elektronen te winnen, te verliezen of te delen om een volledige buitenste schaal van acht elektronen te bereiken (zoals de edelgassen). Dit wordt de Octet -regel genoemd.
3. Elektronenoverdracht:
* natrium (na) wil zijn ene valentie -elektron verliezen om een stabiele octetconfiguratie te bereiken zoals de Noble Gas Neon (NE). Dit maakt het een positief geladen ion (Na+).
* chloor (Cl) wil één elektron winnen om zijn octet te voltooien, die lijkt op het edelgasargon (AR). Dit maakt het een negatief geladen ion (Cl-).
4. Ionische bindingsvorming:
* De tegenovergestelde ladingen van Na+ en Cl- trekken elkaar elektrostatisch aan en vormen een ionische binding.
* De resulterende verbinding, NaCl, heeft een neutrale lading vanwege de balans van positieve en negatieve ladingen.
5. Roosterstructuur:
* NaCl bestaat niet als individuele moleculen. In plaats daarvan vormt het een kristalroosterstructuur waarbij Na+ en clionen zijn gerangschikt in een herhalend patroon, bij elkaar gehouden door elektrostatische krachten.
Samenvattend:
De octetregel helpt verklaren waarom natrium en chloor reageren op NaCl. Natrium verliest een elektron om een stabiel octet te bereiken en chloor krijgt een elektron om hetzelfde te bereiken. De resulterende tegengesteld geladen ionen trekken elkaar aan, die een ionische binding vormen en een stabiele kristalroosterstructuur.
 Olielozingen hebben gevolgen voor het Canadese noordpoolgebied, het milieu en de inheemse volkeren
Olielozingen hebben gevolgen voor het Canadese noordpoolgebied, het milieu en de inheemse volkeren Evolutie van het Alpenlandschap vastgelegd door afzettingsgesteenten
Evolutie van het Alpenlandschap vastgelegd door afzettingsgesteenten Eén gemeenschap in Californië laat zien hoe je het afval uit water kunt halen
Eén gemeenschap in Californië laat zien hoe je het afval uit water kunt halen  Waarom Venetië eigenlijk een schoolvoorbeeld is voor overstromingspreventie
Waarom Venetië eigenlijk een schoolvoorbeeld is voor overstromingspreventie  Hoe invasieve soorten werken
Hoe invasieve soorten werken
Hoofdlijnen
- Neem er een voor het team:hoe bacteriën zichzelf vernietigen om virale infecties te bestrijden
- Wat is de structurele eenheid van de celtheorie?
- Welke organellen hebben de bacteriecel en de plant gemeen?
- Wat is productie in de wetenschap?
- Bescheiden biologen als virussen als leven of niet -leven?
- Nieuwe studie legt uit hoe organen hun ontwikkeling coördineren met het hele lichaam
- Wat zijn enkele voorbeelden van organismen?
- Hoeveel chromosomen zijn er in cellen van het menselijk lichaam?
- Welke kleur zijn de lysosomen in een plantencel?
- Nieuwe textielverfmethode vermindert drastisch het benodigde water en de uitstoot van giftige verfstoffen

- Hoe een functionele moleculaire machine te coderen?
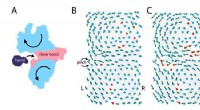
- Kunstmatige cellen reageren op veranderingen in de omgeving
- Biochemicus ontdekt veelbelovend enzym om kankercellen te bestrijden
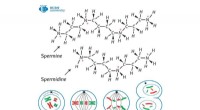
- Onderzoekers helpen bij het ontwikkelen van duurzame polymeren

 Biomassabrandstoffen kunnen de opwarming van de aarde aanzienlijk verminderen
Biomassabrandstoffen kunnen de opwarming van de aarde aanzienlijk verminderen Kan een krachtmassa van een object veranderen?
Kan een krachtmassa van een object veranderen?  Nieuw wetenschappelijk concept voor een Star Wars-achtige trekstraal
Nieuw wetenschappelijk concept voor een Star Wars-achtige trekstraal Bankieren op particuliere financiering om de wereldwatercrisis aan te pakken
Bankieren op particuliere financiering om de wereldwatercrisis aan te pakken Is Yttrium een element van verbinding?
Is Yttrium een element van verbinding?  Wat is een hypotone oplossing?
Wat is een hypotone oplossing?  Wat was de Griekse astronoomtheorie?
Wat was de Griekse astronoomtheorie?  Hoe digitale technologieën de kleine boeren in Afrika kunnen helpen
Hoe digitale technologieën de kleine boeren in Afrika kunnen helpen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

