
Wetenschap
Wat is het verschil tussen natriumion en neonatoom?
1. Aantal elektronen:
* Natriumion (Na+): Heeft 10 elektronen. Het verliest één elektron uit zijn neutrale toestand (11 elektronen) om een stabiel octet in zijn buitenste schaal te bereiken.
* neon atom (ne): Heeft 10 elektronen. Het heeft al een volledig octet in zijn buitenste schaal, waardoor het zeer stabiel is.
2. Laad:
* Natriumion (Na+): Heeft een positieve lading (+1) vanwege het verlies van één elektron.
* neon atom (ne): Heeft geen lading (neutraal). Het heeft een gelijk aantal protonen en elektronen.
3. Reactiviteit:
* Natriumion (Na+): Zeer reactief in zijn neutrale toestand (natriummetaal), maar relatief niet -reactief als een ion vanwege de stabiele elektronenconfiguratie.
* neon atom (ne): Extreem niet -reactief vanwege de volledige buitenste schaal van elektronen. Het is een edelgas.
4. Chemische binding:
* Natriumion (Na+): Vormt ionische bindingen met negatief geladen ionen (anionen) om stabiliteit te bereiken.
* neon atom (ne): Vormt niet gemakkelijk chemische bindingen, omdat het al stabiel is.
Samenvattend:
Natrium en neon hebben, hoewel aangrenzend aan het periodiek systeem, drastisch verschillende eigenschappen vanwege hun elektronenconfiguraties. Natriums wens om een stabiel octet te bereiken, stimuleert zijn reactiviteit, terwijl Neon's reeds stabiele octet het inert maakt.
 Waarom zenden elementen licht uit met de kenmerkende kleur wanneer ze verdampen?
Waarom zenden elementen licht uit met de kenmerkende kleur wanneer ze verdampen?  'S Werelds oudste periodieke tabelgrafiek gevonden in St. Andrews
'S Werelds oudste periodieke tabelgrafiek gevonden in St. Andrews Wat zou je veranderen om een chemische vergelijking in evenwicht te brengen?
Wat zou je veranderen om een chemische vergelijking in evenwicht te brengen?  Waarom schakelt alkylhalidelaag van boven naar beneden op het punt dat water wordt gebruikt Extract organische laag?
Waarom schakelt alkylhalidelaag van boven naar beneden op het punt dat water wordt gebruikt Extract organische laag?  Wat zijn de producten van RB en N2?
Wat zijn de producten van RB en N2?
 De grond zappen met elektriciteit om gedetailleerde bodemkaarten voor boerderijen te maken
De grond zappen met elektriciteit om gedetailleerde bodemkaarten voor boerderijen te maken Wat zou er kunnen gebeuren als bos RS zoals bodembacteriën en schimmels uiteenvallen door een verontreinigende stof?
Wat zou er kunnen gebeuren als bos RS zoals bodembacteriën en schimmels uiteenvallen door een verontreinigende stof?  Oceanografen ontdekken de cruciale rol van het vermengen van zuurstof bij het in stand houden van de gezondheid van de diepzee
Oceanografen ontdekken de cruciale rol van het vermengen van zuurstof bij het in stand houden van de gezondheid van de diepzee  Hoe werd de aarde wetenschappelijk geschapen?
Hoe werd de aarde wetenschappelijk geschapen?  Gazons voor peulvruchten:Minnesota betaalt huiseigenaren om bijengazons te planten
Gazons voor peulvruchten:Minnesota betaalt huiseigenaren om bijengazons te planten
Hoofdlijnen
- Het team leert hoe cellulair eiwit virussen detecteert en een immuunrespons opwekt
- Wat betekent de uitdrukkingsdichtheid van receptorcellen?
- Nieuwe onderzoeken laten zien hoe je parasieten kunt redden en waarom dit belangrijk is
- Is het waar dat planten voedingsstoffen rechtstreeks in fotosynthese gebruiken?
- Wat is een Charcter Trait -grafiek?
- Welke omstandigheden kunnen de groei van bacteriën hebben bevorderd?
- Waarom zou een wetenschapper de stap in de wetenschappelijke methode moeten herhalen?
- Een DNA-model maken met piepschuimballen
- Nieuwe ontdekking vergroot het begrip van hoe planten en bacteriën licht zien
- Robijnen op saffier:recept voor het maken van kristallen in flux
- De uitkomst van de wapenwedloop tussen mens en bacterie voorspellen
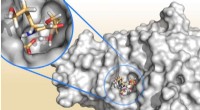
- Nieuwe bio-geïnspireerde hydrogels kunnen werken als superlijm in zeer ionische omgevingen zoals zeewater

- Waarom wordt je katoenen handdoek stijf na natuurlijk drogen?

- Het membraan in membraanloze organellen begrijpen
 Een foton heeft een golflengte 628 nm. De energie van in joules berekenen?
Een foton heeft een golflengte 628 nm. De energie van in joules berekenen?  Hoe wordt energie opgeslagen in natuurlijke gassen en hoe komt dat vrij?
Hoe wordt energie opgeslagen in natuurlijke gassen en hoe komt dat vrij?  Eenvoudig, ontzilting van water op zonne-energie
Eenvoudig, ontzilting van water op zonne-energie Hoe reizen schietsterren zo snel als er geen zwaartekracht is?
Hoe reizen schietsterren zo snel als er geen zwaartekracht is?  Elektromagneetfeiten
Elektromagneetfeiten Wetenschappers bieden een nieuwe richtlijn voor de synthese van fullereen-elektronenacceptoren
Wetenschappers bieden een nieuwe richtlijn voor de synthese van fullereen-elektronenacceptoren Vooruitgang wijst de weg naar kleinere, veiliger batterijen
Vooruitgang wijst de weg naar kleinere, veiliger batterijen Opwarming van het klimaat kan huizen die gevoelig zijn voor natuurbranden onverzekerbaar maken
Opwarming van het klimaat kan huizen die gevoelig zijn voor natuurbranden onverzekerbaar maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

